小明对铁的锈蚀进行如下探究.室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当装置温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录的反应起始和结束量筒的读数以及所需时间如下表.
| 序号 |
样品 |
量筒起始读数/mL |
量筒最终读数/mL |
所需时间/min |
| ① |
1g铁粉、0.2g碳和10滴水 |
100 |
70 |
约120 |
| ② |
1g铁粉、0.2g碳、10滴水和少量NaCl |
100 |
70 |
约70 |
| ③ |
|
- |
- |
- |
(1)实验①和②说明NaCl可以________(填“加快”或“减慢”)铁锈蚀的速率.
(2)实验开始后,广口瓶内温度有所上升,说明铁锈蚀的过程是________(填“放热”或“吸热”)过程.
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质主要成分的化学式是________.
(4)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成.
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积分数是________%(保留3位有效数字).
(6)现仅提供:量筒、大烧杯、玻璃棒、水、滤纸包(内含1g铁粉、0.2g碳、10滴水和少量NaCl),请你帮助小明再设计一个测量空气中氧气体积分数的实验方案,在下图框中画出实验装置示意图即可(注明滤纸包的位置).
下面是某兴趣小组同学做的2个小实验。根据实验内容回答下列问题(仪器的固定装置已经省略)。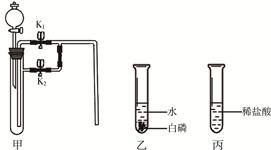
(1)若甲中盛有二氧化锰,连接甲乙装置,关闭K1打开K2,从分液漏斗向甲中加入适量双氧水,关闭分液漏斗活塞,观察到乙中导管口有气泡冒出,白磷不燃烧;关闭K2打开K1,则乙中的现象是 ,且白磷燃烧。
①甲中发生反应的化学方程式是 。
②实验过程中,白磷产生现象差异的原因是 。
(2)若甲中充满二氧化碳(K1、K2关闭),连接甲丙,从分液漏斗向甲中加入适量的澄清石灰水,关闭分液漏斗活塞,一段时间后,打开K1,整个实验过程中观察到甲中的现象是 。
请你完成对实验室制取二氧化碳的实验探究。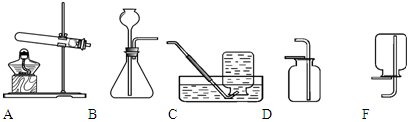
(1)选择药品。下表是对四组药品进行实验的记录:
| 组别 |
药品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
石灰石粉末和稀盐酸[来] |
产生气泡速率很快 |
| ③ |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ④ |
碳酸钠粉末和稀盐酸 |
产生气泡速率很快 |
从制取和收集的角度分析,一般选择第组药品(填字母序号,下同),该组药品发生反应的化学方程式为。
(2)选择装置。选择发生装置。
(3)制取气体。选择装置收集二氧化碳,其验满方法是。
(4)气体检验。将生成的气体通入紫色石蕊溶液中,溶液变红,确定该气体是二氧化碳。这种检验方法是否正确?若正确请说明理由,若不正确请写出正确的检验方法。。
分类是研究物质的一种重要方法,同类物质具有相似的化学性质。学习完二氧
化碳的性质后,某化学兴趣小组的同学发现氢氧化钾与氢氧化钙的组成相似,设计
实验探究二氧化碳能否与氢氧化钾发生反应。
(1)实验准备
查阅资料:通常状况下,1体积的水约能溶解1体积二氧化碳。
(2)实验过程
【方案一】同学们取少量氢氧化钾溶液于试管中,向该溶液中通入二氧化碳气体,无明显现象。得出结论:二氧化碳不能与氢氧化钾发生反应。有的同学提出该结论不正确,理由是_______________________。
【方案二】在老师的帮助下,同学们利用下面的装置,通过实验证明二氧化碳与氢氧化钾确实发生了化学反应。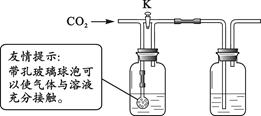
A B
分别取氢氧化钾和氢氧化钙溶液放入A、B中,
① 关闭K,通入二氧化碳,A、B中均无明显变化。B中盛放的溶液是_____。
② 打开K,继续通入二氧化碳。B中溶液变浑浊。B中反应的化学方程式为_____。
同学们依据上述实验现象,得出二氧化碳与氢氧化钾确实发生了化学反应。有同学
认为上述实验不足以证明二氧化碳和氢氧化钾发生了反应,其理由是_____。
③ 同学们用洗涤干净的上述装置重新实验,分别量取50 mL上述溶液放入A、B中,
关闭K,通入约500 mL二氧化碳,A、B中均无明显变化。此实验可以说明二氧化碳和氢氧化钾发生了反应,其理由是_____。
(3)实验反思
通过上述实验说明,对于没有明显现象的化学反应,可以从的角度证明反应的发生。
下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。
小资料:Na2CO3 + H2SO4=Na2SO4 + H2O + CO2↑;
氧化钙(俗称生石灰)与水反应放热。
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
| 滴管甲 |
烧杯① |
滴管乙 |
烧杯② |
|
| 试剂 |
H2O |
MnO2 |
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是________。
根据下图回答问题。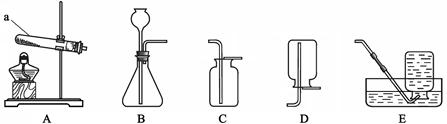
(1)仪器a的名称是。
(2)实验室用高锰酸钾制取氧气的化学方程式为,所选用的收集装置是E或(填字母序号,下同)。
(3)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为,所选用的发生装置是。收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到________,说明瓶中已充满二氧化碳。