.(14分)已知:①A 是一种分子量为28的气态烃;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。
2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。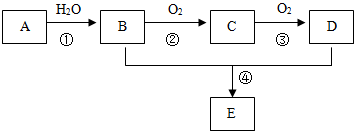
回答下列问题
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:① ;④ 。
(4)写出下列反应的化学方程式:② ;
④ 。
A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示。X位于元素周期表中第四周期ⅠB族。请回答下列问题:
(1)D单质晶体中原子的堆积方式为体心立方堆积,其配位数是。DAB3中阴离子的立体构型是。中学化学常见微粒中,与晶体D3AB4中阴离子互为等电子体的分子有(任写一种)。
(2)X2+离子的电子排布式为______,X2+离子与水分子形成的配离子[X(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[X(H2O)2(Cl)2]具有极性的分子的结构__________。
(3)A元素分别能与硼、铝形成相同类型的晶体,但是A与硼形成晶体的熔点更高,其原因是。
(4)AC3的沸点比氨的沸点低得多,原因是。
(5)若E与C形成的晶体的密度为a g·cm-3,则晶胞的体积是_____ cm3 (用NA表示阿伏伽德罗常数的值,写出表达式即可)。
钛合金是航天航空工业的重要原料。由钛铁矿(主要成分是TiO2和Fe的氧化物)
制备Ti和绿矾(FeSO4·7H2O)等产品的一种工艺流程示意如下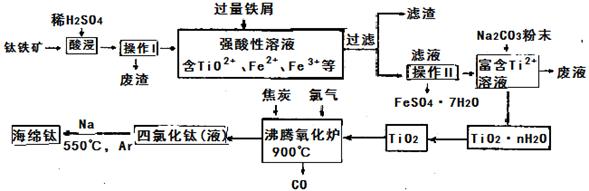
已知:①TiO2+易水解,只能存在于强酸性溶液中②TiCl4的熔点-25℃,沸点136.4℃;SiCl4的熔点-68.8℃,沸点57.6℃ 回答下列问题:
(1)TiCl4的晶体类型是晶体。
(2)TiO2的天然晶体中,最稳定的一种晶体结构如图,其中黑球表示原子。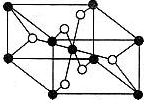
(3)钛铁矿酸浸时,主要成分TiO2反应的离子方程式为。
(4)操作Ⅱ包含的具体操作方法有。
(5)废液中溶质的主要成分是(填化学式)。
(6)沸腾氧化炉中发生反应的化学方程式为,
制得的TiCl4液体中常含有少量SiCl4杂质,可采用方法除去。
(7)若经事先处理后的钛铁矿只含有TiO2和Fe3O4两种氧化物,现有312kg经处理后的钛铁矿,经上述流程后(省去操作Ⅰ)制得了48kg纯净的金属钛。已知在上述流程的强酸性溶液中加过量铁粉时测得转移的电子的物质的量为2a×103mol,则理论上可制得kgFeSO4·7H2O(假设上述各步反应均完全且各步没有损耗)。
碳及其化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)已知:①2CH4(g)+3O2(g)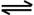 2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+ O2(g)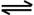 2CO2(g) △H2=-566kJ/mol,
2CO2(g) △H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为。
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+ H2O(g)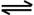 CO(g)+3H2(g)
CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是。
| A.v(CH4)正=3v(H2)逆 |
| B.水蒸气的浓度与一氧化碳的浓度相等 |
| C.平均相对分子质量不随时间的变化而变化 |
| D.密度不随时间的变化而变化 |
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是。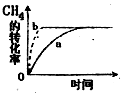
(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) 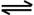 CO2(g)+H2(g);△H得到如下三组数据:
CO2(g)+H2(g);△H得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
CO2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
D |
t |
①实验1中以v(H2)表示的反应速率为。
②实验2中的平衡常数是(计算结果保留两位小数)。
③该反应的△H0(填“>”或“<”)。
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系
是(用含a、b的式子表示)。
有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如下表:
| 元素 |
元素的相关信息 |
| A |
存在多种核素,其中一种核素没有中子 |
| B |
核外电子排布式三个能级上的电子数相同 |
| C |
其第一电离能比同周期相邻元素的第一电离能都大 |
| D |
最外层电子数是内层电子数三倍的元素 |
| E |
单质或其化合物在火焰灼烧时,火焰呈黄色 |
| F |
位于第三周期ⅦA族 |
| G |
未成对电子数最多的副族元素 |
(1)G元素的价层电子排布式为。
(2)D、E、F三种元素的简单离子的离子半径由大到小的顺序是(用微粒符号表示)。
(3)B、C、F三种元素的最高价氧化物的水化物的酸性最强的是(写名称)。
(4)由上述两种元素组成的与O3互为等电子体的负一价阴离子的化学式为。
(5)由B、C、E三种元素的三原子组成的含σ键和π键的离子化合物的电子式。
(6)由A、B、D三种元素组成的有两种官能团的能形成分子内氢键的芳香族化合物的结构简式为(任写一种)。
(7)如图所示装置,两玻璃管中盛满滴有酚酞溶液的EF饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(Ⅱ)的电极反应式是。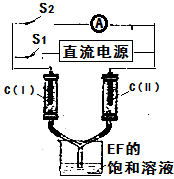
(本题共14分)碘海醇为非离子型造影剂,尤适用于有造影剂反应的高危因素的病人。
下面是以化合物A为原料合成碘海醇的路线:
其中R-为-CH2CH(OH)CH2OH
请回答以下问题:
48.碘海醇的分子式为________。
49.A是苯的同系物,其蒸气相对氢气的密度是53,则A的结构简式是。
50.写出A的侧链与氯气发生一氯取代的条件_____________。
51.反应①→⑤中,属于取代反应的是_____________(填序号)。
52.写出能同时满足下列条件的D的两种同分异构体的结构简式:________。
Ⅰ.苯环上有3个取代基,苯环上的一卤代物有2种;
Ⅱ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应;
Ⅲ.含有1个α-氨基酸的结构(例如: 属于α-氨基酸);
属于α-氨基酸);
53.已知:①
②
③ 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以  和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
(合成路线常用的表示方式为: )
)
__________________________________________________________________________