(每空2分,共12分)键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低? (填“能”或“不能”),原因是 。
(3)如图立方体中心的“· ”表示金刚石晶体中的一个原子,请在立方体的顶点用“· ”表示出与之紧邻的碳原子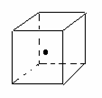
(4)工业上高纯硅可通过下列反应制取:SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________。
有机化合物A、B分子式不同,它们只可能含碳、氢、氧元素中的两种或三种.如果将A、B不论以何种比例混和,只要其物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变.那么,A、B组成必须满足的条件是;.若A是甲烷,则符合上述条件的化合物B中,分子量最小的是(写出分子式),并写出分子量最小的含有甲基的B的2种同分异构体结构简式:,。
用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如下图: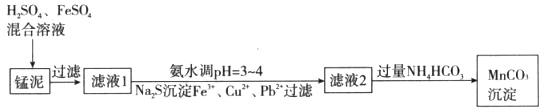
(1)锰泥中加入H2SO4、FeSO4混合溶液,反应的离子方程式是__________。
(2)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/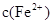 <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe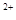 ;
;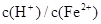 ≥0.7时,滤液1中不能检验出有Fe2+。
≥0.7时,滤液1中不能检验出有Fe2+。
①检验Fe2+是否氧化完全的实验操作是__________。
②生产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请从节约药品的角度分析,原因是__________。
若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的方法是__________。
(3)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(4)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg(已知相对分子质量:MnO2 87;MnCO3 115)。
减少二氧化碳的排放是一项重要课题。
(1)CO2经催化加氢可合成低碳烯烃: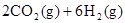

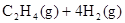
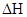
在0.1 MPa时,按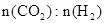 =1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。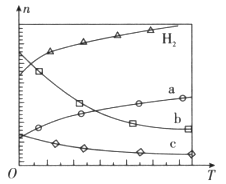
①该反应的△H__________0(填“>”、“=”或“<”)。
②曲线b表示的物质为__________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是__________。
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如下图所示。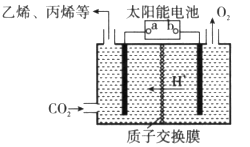
①该工艺中能量转化方式主要有__________。
②b为电源的__________(填“正”或“负”)极,电解时,生成乙烯的电极反应式是__________。
(3)以CO2为原料制取碳(C)的太阳能工艺如图所示。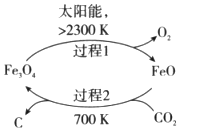
①过程1每反应1mol Fe3O4转移电子的物质的量为__________。
②过程2发生反应的化学方程式是__________。
(4分)某化合物2.3g在足量的氧气中充分燃烧,只生成了4.4g CO2和2.7gH2O。该化合物的相对分子质量是氢气相对分子质量的23倍。该化合物的分子式为________________;若该化合物的1H核磁共振谱只有一个信号峰,则其结构简式为________________。
(6分)某有机物A结构如下: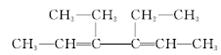
(1)用系统命名法对其命名:_____________________________________________
若该烃完全氢化后再与氯气光照下进行反应,其一氯代物有______种。
(2)烃B与烃A是同分异构体,能使酸性高锰酸钾溶液和溴水褪色,其一氯取代物只有一种结构,烃B的结构简式可以为_______________________________