写出下列有关的化学方程式。
⑴4g CH4在氧气中燃烧生成CO2和液态水,放出222.5kJ热量。写出CH4燃烧的热化学方程式 。
⑵乙醇催化氧化成乙醛的化学方程式 。
⑶苯与溴发生取代反应的化学方程式 。
现有下列4组物质:
| A.CaO、MgO、CO2、CuO | B.H2、Cl2、N2、Cu |
| C.O2、Fe、Cu、Zn | D.HCl、H2O、H2SO4、HNO3 |
(1)填写下表中的空白
| A组 |
B组 |
C组 |
D组 |
|
| 分类标准 |
金属氧化物 |
金属单质 |
||
| 不属于该类别的物质 |
Cu |
H2O |
(2)若上表中的4种物质相互作用可生成一种新物质——碱式碳酸铜[Cu2(OH)2CO3],写出该反应的化学方程式。
(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率(填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是(填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度物质 |
CO |
H2O |
CO2 |
H2 |
| 起始浓度/(mol·L-1) |
2.0 |
x |
0 |
0 |
| 平衡浓度/(mol·L-1) |
0.4 |
6.4 |
1.6 |
1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
(1)把新制的氢氧化铜悬浊液加入到某病人的尿液中并微热,如果观察到红色沉淀,说明尿液中可能含有的物质是()
A.尿酸 B.蔗糖 C. 蛋白质 D.葡萄糖
(2)垃圾处理无害化、减量化和资源化逐渐被人们认识。垃圾的分类收集是实现上述理念的重要措施。某垃圾箱上贴有如图所示的标志,向此垃圾箱中丢弃的垃圾是()
A.危险垃圾 B.有害垃圾 C.可回收物 D.其他垃圾
(3)人类生命活动所需的各种营养主要来自于食物,食物的选择与身体健康关系很大。右表是某位同学的的早餐食谱:
| 主食 |
面包 |
| 副食 |
酱牛肉 |
| 饮品 |
豆浆 |
表中主食含有的营养素主要是(填“糖类”、“油脂”或“蛋白质”,下同);副食含有的营养素主要是, 豆浆所属的分散系为________( 填“溶液”“浊液”或“胶体”)。考虑到营养成分的均衡搭配,你认为应该增加的配菜是。
如下图所示,烧杯中都盛有稀硫酸。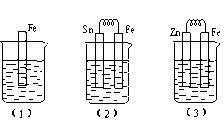
①写出(3)中的电极反应:Fe:、 Zn:。
②比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(填序号)。
下表列出了A-R 9种元素在周期表中的位置
| 周期\族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
(1)填元素符号BD。其中B、D的最高价氧化物对应的水化物的碱性最弱的是(填化学式)。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是。
(3)F元素氢化物的化学式是,该氢化物在常温下跟G元素形成的单质发生反应的化学方程式是。
(4)G元素和H元素两者核电荷数之差是。