有如下合成路线,甲经二步转化为丙: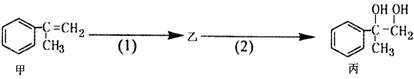
下列叙述错误的是 ( )
| A.甲和丙均可与酸性KMnO4溶液发生反应 |
| B.反应(1)的无机试剂是液溴,铁作催化剂 |
| C.步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲。 |
| D.反应(2)反应属于取代反应 |
一定量的Fe与过量的稀硫酸反应,为了减缓反应速率又不影响生成氢气的总量,不可以采取的措施是
| A.加入K2SO4溶液 |
| B.加入CH3COONa固体 |
| C.加一定量水 |
| D.加入KNO3溶液 |
对于可逆反应mA + nB  pC +qD从正反应开始反应并在一定条件下达到平衡后,如果增大压强,则容器内气体平均相对分子质量增大,下列有关判断错误的是
pC +qD从正反应开始反应并在一定条件下达到平衡后,如果增大压强,则容器内气体平均相对分子质量增大,下列有关判断错误的是
| A.反应物A或B至少有一个是气体 |
| B.容器内不可能是单一气体 |
| C.m+n可能大于p+q |
| D.若m<p,且D是气体,则B一定是气体 |
在相同的温度与体积下,对反应CO2(g) + H2(g)  CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 |
H2 |
CO |
H2O |
|
| 甲 |
amol |
amol |
0mol |
0mol |
| 乙 |
2amol |
2amol |
0mol |
0mol |
| 丙 |
2amol |
2amol |
amol |
amol |
| 丁 |
amol |
0mol |
2amol |
2amol |
上述四种情况,起始的时候正反应速率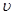 (H2)正大小顺序正确的是
(H2)正大小顺序正确的是
A.丙>丁>乙>甲 B.丙>乙=丁>甲C.丙>乙>甲>丁D.乙=丙>甲>丁
下列关于可逆反应H2(g) + I2(g)  2HI(g)在一定温度与体积条件下达到平衡的判断正确的是
2HI(g)在一定温度与体积条件下达到平衡的判断正确的是
| A.每断裂1mol H-H键的同时断裂1mol I-I键 |
| B.每断裂1mol I-I键的同时生成2mol H-I键 |
| C.每消耗1molH2的同时消耗2molHI |
| D.压强不发生改变 |
对于平衡CO2(g)  CO2(aq) △H <0,为增大CO2在水中的溶解度,应采用的方法是
CO2(aq) △H <0,为增大CO2在水中的溶解度,应采用的方法是
| A.增加压强 | B.升高温度 | C.不断搅拌 | D.升温减压 |