根据你已有的知识和经验,分析下列过程的焓变、熵变,并判断反应的方向。
(1)H+(aq)+OH-(aq)=H2O (l) △S=+80.7J·mol-1·K-1
△H 0,△S 0,该反应 (自发或非自发)
(2)TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+161.9kJ·mol-1 △S=-38.4J·mol-1·K-1
该反应 (自发或非自发)
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:
(1)把化学能转化为电能的装置是(填“甲”或“乙”)。
(2)①若两池中均盛有CuSO4溶液,反应一段时间后,有红色物质析出的是甲池中的棒,乙池中的棒。
②乙池中碳极上电极反应式是。
(3)若两池中均盛有饱和NaCl溶液,
①写出乙池中总反应的化学方程式为,
②若将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变,发生此现象的离子方程式为;若往乙池中滴入酚酞试液,(填铁或碳)棒附近呈现红色。
③若乙池中通过0.02mol 电子后停止实验,反应后池中溶液体积是200mL,溶液混匀后的c(OH-)为。
2SO2(g)+ O2(g) 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
(1)图中A点表示_______________________,a="__________" 。
(2) Ea的大小对该反应的△H _______(填“有” 或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
(3)已知单质硫的标准燃烧热为296kJ·mol-1,写出反应的热化学方程式:________________________ ____,常温常压下,由单质硫和氧气经两步反应,若生成1mol SO3(g),放出的总热量为___ ___ 。
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知: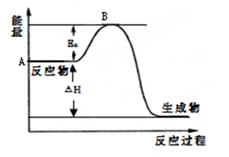
2CO(g)+O2(g)=2CO2(g)ΔH =-566 kJ·moL-1
2H2(g)+O2(g)=2H2O(g)ΔH =-483.6 kJ·moL-1
H2O(g)=H2O(l)ΔH =-44.0 kJ·moL-1
(1)氢气的标准燃烧热△H = kJ·moL-1。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式: 。
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: C(s)+CO2(g)  2CO(g) △H>0
2CO(g) △H>0
测得容器中CO2的物质的量随时间t的变化关系如图所示。
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数K 。(结果保留一位小数)
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填增大、减小、不变、无法确定)。
(4)相同温度下,2L的恒容容器丙中加入4moL碳、4moLCO2和4moLCO。开始反应时v(正) v(逆)(填>、 <、﹦)。
(5)相同温度下,2L的恒容容器乙中加入4moL碳和4moLCO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是,。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。