(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1mol NaHCO3能完全反应,则A的结构简式是 ,写出与A具有相同官能团的A的所有同分异构体的结构简式
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是
⑶某有机物完全燃烧,生成标准状况下CO2的体积为4.48 L,H2O的质量为5.4g。
①若有机物的质量为4.6g,此有机物的分子式为
②若有机物的质量为6.2g,且此有机物lmol能和足量的金属钠反应生成lmolH2,此有机物的结构简式为 (两个羟基不能连在同一个碳原子上)
依据事实,写出下列反应的热化学方程式。
(1)在250C、101KPa时,1克甲醇(CH30H)完全燃烧生成CO2和液态水时放热22.68KJ,则能表示甲醇燃烧热的热化学方程式为。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式为:。
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现已知火箭发射时可用肼(N2H4)为燃料,以NO2作氧化剂,反应生成N2(g)和气态的水,据下列的2个热化学反应方程式:
N2(g)+2O2(g)= 2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= -534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气 态水的热化学反应方程式:
态水的热化学反应方程式:
针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是 ;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式:。
;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式:。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。
(3)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
【实验2】将适量K2FeO4溶 解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是;
②实 验2可得出的结论是;
验2可得出的结论是;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。
现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是(用离子方程式表示)。
(2)写出E溶液与过量的B溶液反应的离子方程式。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H="-a" kJ·mol-1。
请写出相同条件下B与C的稀溶液反应的热化学方程式。
(4)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度 倍。
倍。
(5)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或—1)浓度由大到小的顺序为:。
有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应 前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
前后C、D装置质量的变化,测定该混合物中各组分的质量分数。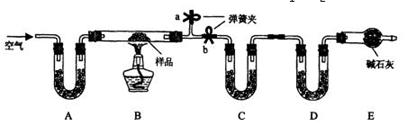
(1)加热前通入空气的目的是 ____________,操作方法为___________________。
(2)装置A、C、D中盛放的试剂分别为A___________,C__________,D__________。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3•10H2O的含量。
(4)若样品质量为 w g,反应后C、D增加的质量分别为 m1 g、m2 g,由此可知混合物中NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)。