(16分)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) ∆H1="a" kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2="b" kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H= kJ∙mol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 。
②在该温度下反应的平衡常数K= 。
③关于上述反应,下列叙述不正确的是 (填编号)。
| A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快 |
| B.缩小容器的体积,平衡将向右移动 |
| C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂 |
| D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆 |
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。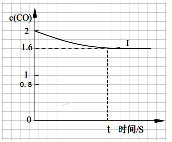
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是 。

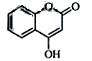
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: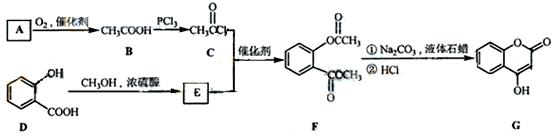


 (1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。 (2)B→C的反应类型是。
(2)B→C的反应类型是。 (3)E的结构简式是
(3)E的结构简式是 (4)写出F和过量NaOH溶液共热时反应的化学方程式:
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
 (5)下列关于G的说法正确的是
(5)下列关于G的说法正确的是 a.能与溴单质反应 b. 能与金属钠反应
a.能与溴单质反应 b. 能与金属钠反应 c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
按要求写出下列化学方程式:(请注明反应条件)
(1) 甲苯 →TNT
(2) 丙烯 → 聚丙烯
(3)  2-溴丙烷→丙烯
2-溴丙烷→丙烯
有A、B 、C、D 4种短周期元素,它们的原子序数由A到D依次增大。①D的氧化物分子式为DO,在D的氧化物中,氧的质量分数为40%,而且D的原子核中,质子数和中子数相等。②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍。③B的阴离子与C的阳离子和Ne原子的电子层结构相同。在一定条件下0.1 mol单质B2 和0.2 mol H2 恰好完全反应,生成0.2 mol氢化物。④C的单质在点燃条件下与B的单质充分反应,可
、C、D 4种短周期元素,它们的原子序数由A到D依次增大。①D的氧化物分子式为DO,在D的氧化物中,氧的质量分数为40%,而且D的原子核中,质子数和中子数相等。②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍。③B的阴离子与C的阳离子和Ne原子的电子层结构相同。在一定条件下0.1 mol单质B2 和0.2 mol H2 恰好完全反应,生成0.2 mol氢化物。④C的单质在点燃条件下与B的单质充分反应,可 生成浅黄色固体,此生成物又可与A、B化合物反应生成B的单质。
生成浅黄色固体,此生成物又可与A、B化合物反应生成B的单质。
(1)写出下列代号对应的元素符号:D _______。
(2)写出AB2的结构式________,所含化学键的类型_________。
(填字母代号A离子键B极性键C非极性键)
(3)B、C两元素可形成两种不同的化合物,写出它们的电子式:___________、____________。
(4)A元素某氧化物与C元素某氧化物反应生成单质的化学方程式是__________________ ___。
___。
(10分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,写出反应①的化学方程式_________________;用电子式表示C的形成过程:__________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行。如果将反应①设计成原电池,负极电极材料可选择_____(填字母代号A铁片B锌片C铜片),正极电极反应式为:_____________________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为______________________________。
(8分) 已知3A(g)+B(g)  xC(g)+2D(g),将等物质的量的A、B混合于2 L的密闭容器中,经5 min后达到化学平衡,此时测得D的浓度为0.5 mol/L,且c(A)∶c(B)=3∶5。又知5 min 内用C表示的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),将等物质的量的A、B混合于2 L的密闭容器中,经5 min后达到化学平衡,此时测得D的浓度为0.5 mol/L,且c(A)∶c(B)=3∶5。又知5 min 内用C表示的平均反应速率为0.1 mol/(L·min)。求:
(1)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(2)5min内用B表示的平均反应速率v(B)= ________mol/(L·min);
________mol/(L·min);
(3)此时A的转化率为_______,x的值为________。