(10分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: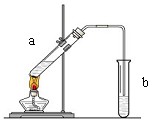
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中。 |
试管A中产生气泡量减少;试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5mL 5%H2O2溶液和5mL 10%H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为________。
(2)实验①的目的是________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最快的是______(填“A”或“B”或“C”)。
(5)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: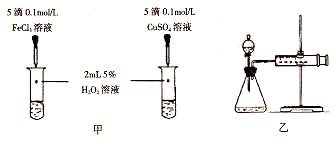
①定性分析:如图甲可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________。
14分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)从0~3分钟时间段内,产生氢气的速率是如何变化的?答:___________________。
造成这种变化的主要因素是_________________;从3~5分钟时间段内,产生氢气的速率是如何变化的?答:_________。造成这种变化的主要因素是_____________________。
(2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是___________(双选题,漏选得1分,多选,错选得0分)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的是在____分钟时间段内,在该时间段内盐酸的反应速率为(设溶液体积不变,上述气体体积为标况下数据)。
.某学生根据石蜡油在碎瓷片或氧化铝催化作用下能分解得到乙烯的性质,设计下图的实验装置。据图回答: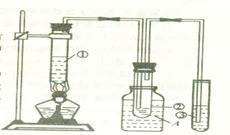
(1)试管①中盛的是_____________________;
(2)试管①至试管②上部导管的作用是______;
(3)装置A的作用是_______________________;
(4)试管③中盛的是__________________,反应后观察到的现象是___________________;
(5)若往试管②的液体中滴入溴的四氯化碳溶液,发现溴的颜色褪去,则说明液体中含有___________烃。
以下是某课题组设计的由烃A合成聚酯类高分子材料。 的路线:
的路线: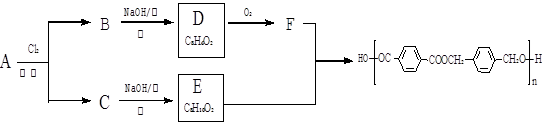
已知同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。
根据以上信息回答:
(1)A的分子式,F中官能团的名称是。
(2)化合物D的结构简式是,由B生成D的反应过程中生成的不稳定中间体的结构简式是,该中间体生成D的反应类型为。
(3)E与F反应的化学方程式是,反应类为。与E具有相同官能团的含苯环的同分异构体有(写结构式)。
(17分)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
(2)反应中加入过量的乙醇,目的是__________________________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是_____________________
_____________________________________________________。
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图: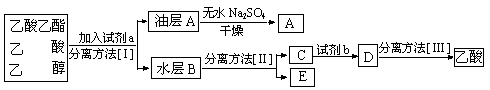
则试剂a是:____________,分离方法I是____________,分离方法II是____________,
试剂b是______________,分离方法III是______________。
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。
丙同学分析了上述实验目标产物后认为上述实验没有成功。
试解答下列问题:
①甲实验失败的原因是:_______________________________________________
②乙实验失败的原因是:_______________________________________________