A、B、C为短周期元素,在周期表中如图所示: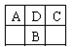 A、C两种元素的原子核外电子数之和等于B原子的核电荷数。有关说法错误的是
A、C两种元素的原子核外电子数之和等于B原子的核电荷数。有关说法错误的是
A.A的氧化物有多种形式
B.B最高价氧化物对应的水化物是一种弱酸
C.C的氢化物比HCl稳定
D.D元素形成的单质不止一种
除去FeCl3溶液中的Fe(OH)3胶体,可行的方法是
| A.过滤 | B.蒸发 |
| C.加入适量的盐酸 | D.加入适量的NaOH溶液 |
下列反应中必须加入还原剂才能进行的是
| A.Cl2→Cl- | B.Zn→ Zn2+ |
| C.H2→H2O | D.CuO→CuCl2 |
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
I2+SO2+2H2O H2SO4+2HI2FeCl2+Cl2
H2SO4+2HI2FeCl2+Cl2 2FeCl3
2FeCl3
2FeCl3+2HI 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
| A.所用NaOH已经潮解 |
| B.向容量瓶中加水未到刻度线 |
| C.有少量NaOH溶液残留在烧杯里 |
| D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
过滤后的食盐水仍含有可溶性的CaCl2、Mg Cl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤
Cl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤 正确的操作顺序是
正确的操作顺序是
| A.③②①⑤④ | B.①②③⑤④ | C.②③①④⑤ |
D.③⑤②①④ |