现提供如下除杂试剂和提纯方法:
| 除杂试剂 |
① 酸性高锰酸钾溶液 ②溴水 ③饱和碳酸钠溶液 ④氢氧化钠溶液 |
| 提纯方法 |
A蒸馏 B萃取 C分液 D洗气 |
从上表中选择合适的除杂试剂和提纯方法填入下表空格内(填序号或字母),下表甲栏括合内为杂质。
| 甲 |
除杂试剂 |
提纯方法 |
| 甲烷(乙烯) |
|
|
| 乙酸乙酯(乙酸) |
|
|
绿矾是一种重要的化工原料。
【问题1】绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质。为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)方案1:取少量溶液,加入几滴试剂(写化学式),如果观察到的现象是溶液变血红色;实验结论:证明绿矾样品已被氧化。
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是。实验结论:证明绿矾样品完全被氧化。
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式。
(4)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有 (此空填序号)
| A.蒸发皿 | B.石棉网 | C.烧杯 | D.玻璃棒 |
【问题2】灼烧绿矾的反应方程式:2(FeSO4·7H2O)Fe2O3+SO2↑+SO3↑+14H2O
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入下图所示的装置中。请回答以下问题: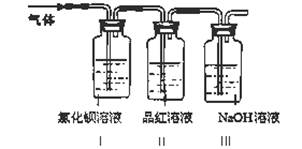
(1)装置I中氯化钡溶液中可观察到现象。若氯化钡溶液足量,将最后所得沉淀过滤、洗涤、烘干后称重为2.33克,则灼烧绿矾的过程中转移了_________mol的电子。
(2)装置II中试剂为品红溶液,其作用是
(3)装置III中试剂为NaOH溶液,其作用是。
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20% KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
| 沉淀物 |
开始沉淀时的pH |
沉淀完全时的pH |
| Mg(OH)2 |
9.6 |
11.1 |
| Fe(OH)3 |
2.7 |
3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| …… |
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 |
同一反应温度 |
|||||
| 反应温度/℃ |
转化率(%) |
选择性(%)* |
反应时间/h |
转化率(%) |
选择性(%)* |
|
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
| 60 |
92.3 |
100 |
3 |
87.8 |
100 |
|
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为________。
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 |
饱和碳酸钠溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
0.1 |
|
| C |
3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 |
1.2 |
|
| D |
3 mL乙醇、2 mL乙酸、盐酸 |
1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_______________________________________________________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是____________________________________________(答出两条即可)。
教材中给出了Na2O2与H2O反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑。为了探究Na2O2与H2O反应的机理,某学习探究小组在教师指导下设计了如图所示装置进行实验。
实验步骤如下:
①按图示组装仪器,并检查装置气密性为良好后装入药品。
②保持K1打开、K2关闭,将注射器中的蒸馏水推入试管中,此时试管中并无气体产生。
③挤压装有酚酞的胶头滴管,使酚酞滴入试管中,试管中溶液显红色。
④挤压装有稀盐酸的胶头滴管,使稀盐酸滴入试管中,红色消失后再滴加2滴。
⑤用双连打气球向A中试管中鼓气,使试管中溶液通过喷头进入B中支管中,发现淀粉-KI溶液变蓝,KMnO4溶液褪色。
⑥迅速打开K2、关闭K1,继续向A中试管中鼓气,待试管中溶液进入C中试管中约三分之一时停止鼓气。然后用热水浴加热C中试管片刻,有气泡冒出,经检验为氧气。
请回答下列问题:
(1)用离子方程式表示淀粉-KI溶液变蓝的原因:_____________________________
________________________________________________________________________。
(2)用离子方程式表示KMnO4溶液褪色的原因: ______________________________
________________________________________________________________________。
(3)A中用冰盐冷浴和C中用热水浴的作用分别是________、______________________。
(4)Na2O2与H2O反应的机理是____________________(用化学方程式表示)。