下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的Cu(NO3)2溶液时,当有0.2 mole-转移时会析出6.4g铜 |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为()
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为()
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
将2 mol A和1 mol B充入一个密闭容器中,在一定条件下发生:2A(g)+B(g) xC(g)达到平衡,测得C的物质的量分数为c%;若开始充入容器中的是0.6 mol A,0.3 mol B和1.4 mol C,达平衡时C的物质的量分数仍为c%,则x的值可能为
xC(g)达到平衡,测得C的物质的量分数为c%;若开始充入容器中的是0.6 mol A,0.3 mol B和1.4 mol C,达平衡时C的物质的量分数仍为c%,则x的值可能为
| A.2 | B.3 | C.4 | D.5 |
下列关于实验现象的描述不正确的是 ( )
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片作负极,铁片作正极,稀硫酸为电解质溶液一段时间后,溶液PH增大 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓海轮腐蚀 |
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是 ( )
| A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 |
| B.同价态的阳离子,甲比乙的氧化性强 |
| C.甲能跟稀盐酸反应放出氢气而乙不能 |
| D.将甲、乙作电极组成原电池时,甲是正极 |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(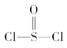 )中而形成的,电池总反应方程式为:
)中而形成的,电池总反应方程式为:
8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是 ( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |