在一个容积为2L的密闭容器中,发生如下反应:3A + B  2C (A、B、C均为气体),若最初加入的A、B都是4 mol,A的平均反应速率为0.12 mol/(L·s),则10s后容器中的B是
2C (A、B、C均为气体),若最初加入的A、B都是4 mol,A的平均反应速率为0.12 mol/(L·s),则10s后容器中的B是
A、2.8 mol B、3.2mol C、1.6 mol D、3.6 mol
下列物质中一定与苯酚互为同系物 的是
的是
A.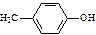 |
B.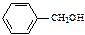 |
C.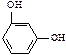 |
D.C7H8O |
下列化合物的分子中,所有原子一定处于同一平面的是
| A.乙烷 | B.甲苯 | C.溴苯 | D.苯酚 |
我国国家药品监督管理局在2000年11月16日发出紧急通知,立即禁止使用含有PPA的抗感冒药物。PPA是盐酸苯丙醇胺的英文缩写,已知苯丙醇胺的结构简式如右图所示,下列对苯丙醇胺叙述错误的是: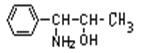
| A.一定条件下,可以发生消去反应 | B.一定条件下与Br2可以发生苯环上的取代反应 |
| C.具有弱碱性,可与强酸反应生成盐 | D.具有弱酸性,可与强碱反应生成盐 |
下列说法正确的是
| A.蛋白质、乙酸和葡萄糖均属电解质 |
| B.用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯 |
| C.乙酸乙酯和食用植物油均可水解生成乙醇 |
| D.蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
设NA 为阿伏加德罗常数,下列有关说法正确的是
| A.0.5 mol苯分子中含有C=C双键数为1.5 NA |
| B.1 mol甲基(—CH3)所含的电子总数为10 NA |
C.标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为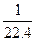 NA NA |
| D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |