(1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析: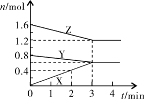
①该反应的化学方程式: ;
②反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
③3min后图中曲线所表示的含义是 。
(2)(4分)下图为石油蒸馏的装置图,根据此图回答下列问题。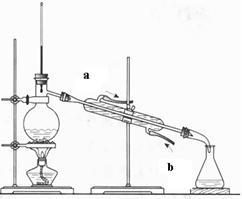
①温度计的水银球插在什么位置?
②蒸馏烧瓶中除了加入石油外还要加入什么?
③冷却水的流动方向如何?(填A或B,下题同)
A、a→b B、 b→a
④得到的汽油、煤油是纯净物吗?
A、是 B、不是
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及 电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题:
电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题: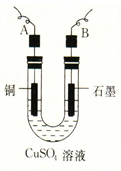
(1)该装置中B电极为电解池的极(填“阴”或“阳”);
(2)A电极上的电极反应式为;
电解池总反应的离子方程式为;
(3)电解过程中,电解质溶液的酸性(填“增强”、“减弱”或“不变”);
(4)下列实验操作中必要的是(填写字母);
| A.称量电解前的电极的质量; |
| B.电解后,电极在烘干称量前,必须用蒸馏水冲洗; |
| C.刮下电解后电极上析出的铜,并清洗,称量; |
D.电解后烘干称重的操作中必须按“烘干→称量 →再烘干→再称量”进行; →再烘干→再称量”进行; |
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计算式表示)。
为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH(g)+H2O(g)


 △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答
△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答 :
: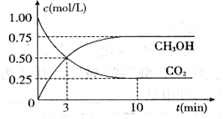
(1)达到平衡的时刻是____________min(填“3”或“10”)。 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率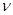 (CO2)="________"
(CO2)="________"
(2)能判断该反应达到化学平衡状态的依据是。 a.容器压强不变 b.混合气体中c(CO2)不变
a.容器压强不变 b.混合气体中c(CO2)不变
c.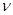 (CH3OH)=
(CH3OH)= 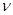 (H2O) d.c(CH3
(H2O) d.c(CH3 OH)=c(H2O)
OH)=c(H2O) (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4④0.1mol/L NH3·H2O和 0.1mol/L NH4Cl混合液⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4④0.1mol/L NH3·H2O和 0.1mol/L NH4Cl混合液⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是;c(NH4+)最小的是﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是②③﹝填“>”、“<”或“=”)
(4)在溶液④中NH3·H2O和离子的物质的量浓度之和为0.2 mol/L。
甲烷、乙烷的一氯取代物不存在同分异构体,则碳原子数少于10的烷烃分子中还有哪些烷烃的一氯取代物也不存在同分异构体?请写出这些烷烃的结构简式。(有几种写几种)
FeSO4·7H2O晶体在空气中易被氧化,为检验其是否已被氧化,可取少量样品溶于适量水后加入溶液检验;如已氧化,可向其中加入过量以除去其中的Fe3+,反应的离子方程式为