下列叙述正确的是
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.右图中电子由Zn极流向Cu,盐桥中的Cl–移向CuSO4溶液 |
| C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e–=2H2O |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列与滴定实验有关的说法中正确的是
| A.用NaOH滴定盐酸时,只能用酚酞作指示剂 |
| B.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
| C.用滴定管准确量取20.0 mL盐酸 |
| D.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
| A.1 mol·L-1NaCl溶液含有NA个Na+ |
| B.1 L 0.1 mol·L-1氨水含有0.1 NA个OH- |
| C.电解饱和食盐水若产生2 g氢气,则转移2 NA个电子 |
| D.将0.1 mol氯化铝溶于1 L水中,所得溶液含有0.1 NA个Al3+ |
下列有关电离或离子方程式中,正确的是
A.将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O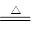 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.用FeS去除废水中的Hg2+:Hg2+ + S2-=== HgS↓ |
C.用惰性电极电解MgCl2溶液: 2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
D.KHS溶液中HS-的电离:HS-+ H2O  H3O+ + S2- H3O+ + S2- |
水的电离过程为H2O H++OH—,在不同温度下其平衡常数为Kw (25℃)=1.0×10-14,Kw (35℃)=2.1×10-14。则下列叙述正确的是
H++OH—,在不同温度下其平衡常数为Kw (25℃)=1.0×10-14,Kw (35℃)=2.1×10-14。则下列叙述正确的是
| A.水的电离是一个放热过程 |
| B.35℃时,c(H+)>c(OH-) |
| C.25℃时,pH=3的盐酸中由水电离产生的c(OH-)=1.0×10-3mol/L |
| D.25℃时,向溶液中加入稀氨水,平衡逆向移动,Kw不变 |
下列叙述与盐类水解无关的是
| A.Na2CO3溶液不能盛装在玻璃塞的试剂瓶中 |
| B.饱和食盐水使甲基橙显黄色 |
| C.FeCl3溶液加热蒸干得到Fe2O3 |
| D.0.1mol/LCuCl2溶液中,c(Cu2+)<0.1mol/L |