化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分。利用已学知识对下列实验进行分析并填空:
Ⅰ.
实验


实验结论 结论:
FeCl3在实验中的作用为:
反应方程式
II.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:
阅读上述资料和实验过程,完成下列填空:
(1)请从下方乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品。
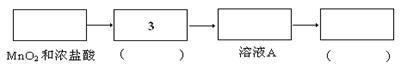
(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为 (填选项字母)
A. 碘水 B. 淀粉碘化钾溶液
C. 新制氯水和四氯化碳 D. 食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A. 四氯化碳 B. 水 C. 乙醇 D. 苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为 %
三硅酸镁为白色无味粉末,不溶于水和乙醇,易与无机酸反应.有关部门规定三硅酸镁样品中含水量不超过12.2%为优良级.某化学兴趣小组欲测定三硅酸镁的化学式(可用MgxSi3Oy·mH2O表示),实验步骤如下:
步骤一:取16.6 g三硅酸镁样品,充分加热至不再分解,冷却、称量,得固体13.0 g.
步骤二:另取16.6 g三硅 酸镁样品,向其中加入足量100 mL 4mol/L的盐酸,充分反应后,过滤、洗涤、灼烧,得固体9.0 g.该固体为空间网状结构,且熔沸点
酸镁样品,向其中加入足量100 mL 4mol/L的盐酸,充分反应后,过滤、洗涤、灼烧,得固体9.0 g.该固体为空间网状结构,且熔沸点 很高.
很高.
(1)通过计算确定MgxSi3Oy·mH2O的化学式.
(2)该小组测定的三硅酸镁样品是否为优良级?
(3)写出该三硅酸镁样品与盐酸反应的化学方程式.
(14分,每空2分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下: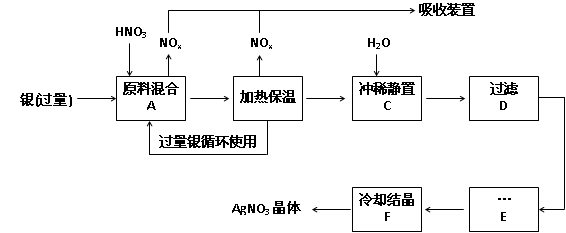
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
| 优点 |
缺点 |
|
| 使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
| 使用稀硝酸 |
(2)步骤B加热保温的作用是:
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是: ;
;
(5)步骤E进行的操作是 。
。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反 应的化学方程式为:。
应的化学方程式为:。
实验室盛放氢氧化钠溶液的试剂瓶不用玻璃塞,是因为玻璃中含有(填化学式),刻蚀玻璃常用的试剂是(填化学式),发生反应的化学方程式为,传统陶瓷的主要成分是类物质。
完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷
的性质实验。
在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和
3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管
I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加
热时反应的化学方程式
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有_、(写出两种有机 物的结构简式)
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 (答两点措施)
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是_;下图中右边试管中的现象是;水的作用是
中和滴定实验⑴取体积相同(25mL)的两份 溶液,将其中一份放在空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)其原因是。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为
溶液,将其中一份放在空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)其原因是。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为 ,中和另一份溶液消耗盐酸的体积为
,中和另一份溶液消耗盐酸的体积为 ,则(1)以甲基橙为指示剂
,则(1)以甲基橙为指示剂 和
和 的关系是。(2)以酚酞为指示剂时,
的关系是。(2)以酚酞为指示剂时, 和
和 的关系是。
的关系是。
⑵某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作()
| A.在250mL的容量瓶中定容配成250mL烧碱溶液 |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
| D.将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1 |
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:(1)正确操作步骤的顺序是(用字母填写)→→→ D →。
(2)滴定管的读数应注意。
(3)E中在锥形瓶下垫一张白纸的作用是。(4)D步骤中液面应调节到,尖嘴部分应。
(5)滴定终点时锥形瓶内溶液的pH约为,终点时颜色变化是。
(6)若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(指偏高、低或不变)(7)该烧碱样品纯度的计算式为。