氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是氧化剂,C是还原剂 |
| B.上述反应中,每生成1 mol AlN需转移3 mol电子 |
| C.AlN中氮的化合价为+3 |
| D.AlN的摩尔质量为41 g |
下列实验操作或装置(略去部分加持仪器)正确的是
| A.图Ⅰ表示为配制一定物质的量浓度稀硫酸时的操作 |
| B.图Ⅱ表示为配制一定物质的量浓度的溶液定容时的操作 |
| C.用图Ⅲ所示装置吸收氯气中的氯化氢气体 |
| D.用图Ⅳ所示装置收集一氧化氮气体 |
硫酸、盐酸和硝酸与烧碱和纯碱并称为工业上的“三酸两碱”。下列说法正确的是
| A.等质量的铝与足量的烧碱和盐酸反应生成氢气的质量相同 |
| B.等质量的铜与足量的浓硫酸和浓硝酸反应生成气体的物质的量相同 |
| C.相同物质的量的烧碱和纯碱与足量盐酸反应,消耗盐酸的体积相同 |
| D.相同质量的硫与足量烧碱、浓硫酸、浓硝酸反应,转移电子数相同 |
A、B、C、D、E为短周期元素,其原子序数依次增大。其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子。则下列说法正确的是
A.D氢化物的稳定性比B氢化物的稳定性强
B.5种元素中,E元素氧化物的水合物的酸性最强
C.A与B、D分别可形成AB2、AD2的化合物
D.B和C可形成离子化合物,且C离子的半径大于B离子的半径
下列有关图像的叙述错误的是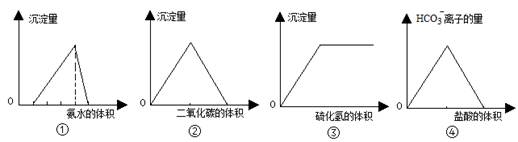
| A.①图可表示向酸化的AlCl3溶液中逐滴加入稀氨水,沉淀量与氨水体积的关系 |
| B.②图中可表示向澄清石灰水中通入二氧化碳气体,沉淀量与二氧化碳体积的关系 |
| C.③图中可表示向亚硫酸溶液中通入硫化氢,沉淀量与硫化氢气体的关系 |
| D.④图中可表示向碳酸钠溶液中逐滴加入稀盐酸,HCO3-离子的量与盐酸体积的关系 |
氯化亚砜(SOCl2,结构式如图)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2=SOCl2+SO2,
下列有关说法正确的是
| A.SCl2和SOCl2中S的化合价分别为+2、+4价 |
| B.制备反应中,二氧化硫是氧化产物 |
| C.每消耗1mol SCl2,转移1mol电子 |
| D.SOCl2分子中既含有离子键又含有共价键 |