家用铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e- =4OH- | D.Fe-3e-=Fe3+ |
设NA表示阿伏加德罗常数,下列说法正确的是()
| A.标准状况下,22.4LCH4和CH2Cl2的混合物所含有的分子数目为NA |
| B.3g的甲基中含有的电子数为1.6NA |
| C.0.5mol的有机物C15H32中含有的共键数为24NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
某混合气体由两种气态烃组成,取20mL该混合气体在足量的O2中完全燃烧生成了50mLH2O(g)和40mL CO2 (在同温同压下测定)。该混合气体的组成和体积之比都正确的是()
| A.C2H4、C2H6,体积比为3﹕1 | B.CH4和C3H6,体积比为1﹕1 |
| C.C2H2和C2H4,体积比为3﹕2 | D.C2H6和C2H8, 体积比为1﹕2 |
国际奥委会于2010年2月10日宣布,有30名运动员因为兴奋剂药检呈阳性,从而被取消参加2010年温哥华冬季奥运会的资格。右图是其中检测出的某种兴奋剂的结构。关于它的说法中正确的是()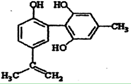
| A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| B.该分子中的所有碳原子不可能共平面 |
| C.1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4mol和7mol. |
| D.该物质滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
下列实验可达到实验目的的是()
A.将 与NaOH的醇溶液共热制备CH3—CH═CH2 与NaOH的醇溶液共热制备CH3—CH═CH2 |
B.乙酰水杨酸 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 |
| C.用蒸馏法分离苯和溴苯的混合物 |
| D.向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 |
下列除去杂质所加试剂和方法都正确的是()
①除去乙烷中混有的少量乙烯:通过酸性KMnO4后,洗气;
②除去硝基苯中混有的少量NO2:加少量NaOH溶液,分液;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙炔中混有的少量H2S、PH3: 通过CuSO4溶液,洗气;
⑤除去乙烯中混有的少量CO2、SO2: 通过NaOH溶液,洗气;
⑥除去溴苯中混有的少量溴:加入KI溶液,分液。
| A.①②③⑤ | B.②④⑤ | C.③④⑤ | D.②③⑥ |