已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
(1)W在周期表中的位置: 。
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2 (g) + Y2(g)  2YX3(g) △H
2YX3(g) △H
反应各物质的量浓度随时间变化如下:
①计算该温度下此反应的平衡常数K= 。
②若升高温度平衡常数K减小,则△H 0(填“>”、“<”或“=”)。
③改变下列条件,能使该平衡向正反应方向移动且平衡常数不变的是 (填字母)。
a.增大压强 b. 降低温度 c.使用催化剂 d. 增大反应物的浓度
(3)常见液态化合物X2Z2的稀溶液易被催化分解,可使用的催化剂为 (填字母)。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,将常温下0.1mol·L-1的A溶液稀释至原体积的10倍后溶液的pH=12,则A的电子式为 。
(5)以X2为燃料可制成燃料电池。已知:2X2(g)+Z2(g)=2X2Z(l) △H=−572KJ·mol-1
该燃料电池释放228.8KJ电能时,生成1mol液态X2Z,该电池的能量转化率为 。
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答下列问题:
(1)Y的最高价氧化物对应水化物的化学式是____________________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式____________。
此液体具有的性质是____________(填字母)。
| A.光束通过该液体时形成光亮的“通路” |
| B.插入电极通直流电后,有一极附近液体颜色加深 |
| C.向该液体中加入硝酸银溶液,无沉淀产生 |
| D.将该液体加热、蒸干、灼烧后,有氧化物生成 |
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率__________。
②原无色有刺激性气味的气体与含1.5 mol Y的含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应。可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是(用单线桥表示电子转移方向和数目):_____________________________________________。
(4)室温时,pH=5的HY溶液和pH=5的ZY3溶液中,水电离出的氢离子分别是mol·L-1和
mol·L-1
(12分)研究氮、硫元素的化合物具有重要意义。
(1)t0℃,p0kpa时,向固定容积为2L的密闭容器中充入2.0 mol SO2和1.0molO2,5分钟后达到平衡,测得生成1.0mol SO3(g),放出热量98.0kJ,则v(O2)=__________mol·L-1·min ,若继续通入2.0mol SO2和1.0mol O2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,__________mol<n(SO3)<__________mol。
,若继续通入2.0mol SO2和1.0mol O2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,__________mol<n(SO3)<__________mol。
已知t0℃,p0kpa时,N2和O2反应的能量变化如图所示:
则t0℃,P0kpa时,SO2与NO反应生成N2和SO3的热化学方程式为____________________。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g) 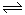 SO3(g)+NO(g),下列能说明反应达到平衡状态的是________(填写代号)。
SO3(g)+NO(g),下列能说明反应达到平衡状态的是________(填写代号)。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO2和SO2的体积比保持不变
d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:4,则平衡常数K=_____________。
(3)一定温度下,向氨水中加水稀释的过程中,NH3·H2O的电离程度______________(填“增大”、“减小”或“不变”,下同),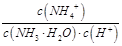 ________________。
________________。
(12分)电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义。
(1)电解方法精炼粗铜,电解液选用CuSO4溶液,精炼过程中电解质溶液的浓度______________(填写“增大”、“减小”或“不变”)。铜在潮湿空气中会被锈蚀,写出该反应的化学方程式______________,锈蚀过程中发生了原电池反应,该电池的正极反应式为______________。
(2)研究发现有机合成反应可形成原电池,既生产产品,又生产电能。例如烯烃生产卤代烃的反应就可制成原电池,若电池总反应表示为:
则该原电池的负极反应式为_________________________。
(3)如图为Mg-NaClO燃料电池结构示意图,已知电解质溶液为NaOH溶液,且两电极中一个为石墨电极,一个为镁电极。
Y电极材料为_____________,X电极发生的电极反应式为_____________,若该电池开始时加入1L0.2 mol NaOH溶液,然后从下口充入1L 0.1mol
NaOH溶液,然后从下口充入1L 0.1mol NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的pH=_______________。
NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的pH=_______________。
(13分)实验室以含有少量铁的粗铜粉和硫酸与硝酸的混合溶液为原料制备CuSO4·5H2O(胆矾)晶体。设计的工艺流程图如下: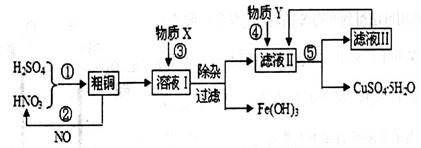
请回答下列问题:
(1)根据反应原理,操作①所需的混酸溶液中硝酸和硫酸的理论配比(物质的量之比)为________。操作②中需要把NO与_____气体混合通入水中,混入该气体的目的是__________________________(用化学方程式表示)。
(2)溶液I中存在一定浓度的Fe3+、Cu2+,在该浓度时生成氢氧化物沉淀的pH如下表。操作③中某学生设计物质X为H2O,若加水调整溶液pH,则Fe(OH)3开始沉淀的pH_______1.9(填“<”、“>”或“=”);而实际操作中一般不用此法调节溶液pH,其主要原因是___________________。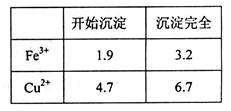
(3)操作④中物质Y为_______。查阅资料知CuSO4·5H2O的溶解度曲线如图所示,则操作⑤应采取的措施是蒸发浓缩、______________、过滤、洗涤、干燥等。
(4)为测定胆矾中结晶水的数目,称取25.0g胆矾品体在坩埚中加热,固体质量随温度升高而变化的曲线如图。
当固体质量为8.0g时,观察到固体完全呈黑色。请列式计算开始称取的胆矾中结晶水的数目。
(13分)SO2是主要大气污染物之一。工业上烟气脱硫的方法如下:
请回答下列问题:
(1)石灰—石膏法的流程如图: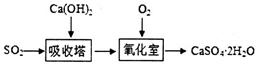 。
。
该法原料便宜,产物有利用价值。写出氧化室中发生反应的化学方程式_______________。
(2)碱法的流程如图: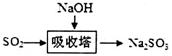 。该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物X为________。操作过程中测得吸收塔内溶液pH=7,则溶液中含硫微粒的浓度由大到小的顺序为_______________。(已知:
。该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物X为________。操作过程中测得吸收塔内溶液pH=7,则溶液中含硫微粒的浓度由大到小的顺序为_______________。(已知: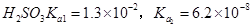 )。
)。
(3)工业上在石灰—石膏法和碱法的基础上,结合两种方法的优点,设计出新的脱硫方案如下:
其中物质Y的化学式为_______,转化塔中反应的化学方程式是__________。
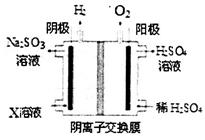
(4)最近利用碱法得到产物X的溶液电解制硫酸的工艺己被某些工厂采用。其装置如图所示(电极为惰性电极)。阴极的电极反应式是__________,透过阴离子交换膜的离子主要为_________。该装置使X转化为硫酸的转化率不会超过________。