在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g),下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n mol CO的同时生成n mol H2 |
| D.1 mol H—H键断裂的同时2 mol H—O键断裂 |
我国城市环境污染中的大气污染物主要是 ( )。
| A.CO2、Cl2、N2、酸雨 |
| B.SO2、NO2、CO、烟尘 |
| C.NH3、CO2、NO、雾 |
| D.HCl、SO2、N2、粉尘 |
你认为减少酸雨产生的途径可采取的措施( )。
①少用煤作燃料;②把工厂的烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E﹤A, R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素, Z原子核外电子数为24。
请回答下列问题:
(1)基态Z原子的核外电子排布式是。AE2+与二氧化碳分子互为等电子体,AE2+的电子式是____。AX3分子的VSEPR模型是。
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为______。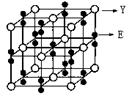
(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是。
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是。
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是。
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g,FeCl2 0.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
| A.100mL的盐酸中HCl物质的量浓度为7.5mol/L |
| B.生成的H2S气体在标准状况下的体积为2.24L |
| C.该磁黄铁矿中FexS的x=0.85 |
| D.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1 |
在一定条件下,CO(g)和H2(g)发生反应:CO(g) + 2H2(g)  CH3OH(g)△H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
CH3OH(g)△H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
下列说法中正确的是
| A.热化学方程式中a>0 |
| B.T1℃下,在第一小时内用H2表示的化学反应速率为0.4mol/(L.h) |
| C.T1℃下,该反应的化学平衡常数为25 |
| D.T2℃下,ɑ1=ɑ2﹥80% |