某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入30g稀硫酸,充分反应后测得实验结果如下:
| 实验次数 |
1 |
2 |
3 |
| 稀硫酸质量 |
10g |
10g |
10g |
| 氢气质量 |
0.04g |
m |
0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中铜的质量分数。
为了测定某生理盐水的溶质质量分数,实验过程和有关实验数据如图所示: 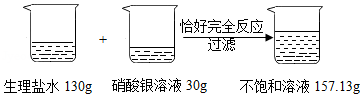
计算:
(1)反应后生成氯化银的质量是 g。
(2)该生理盐水的溶质质量分数是多少?
(化学方程式:NaCl+AgNO 3═AgCl↓+NaNO 3)
有一不纯的氯化钠固体样品(杂质不溶于水),取样品25克放入烧杯中,然后加入80克水使其充分溶解,静置后过滤取58.5克滤液,加入126.2克硝酸银溶液恰好完全反应生成白色沉淀,过滤后得到156克溶液。
计算:(1)生成白色沉淀的质量。
(2)58.5克滤液中溶质的质量分数。
(3)样品中氯化钠的质量分数。
将含有可溶性杂质的某氯化钠样品1.5g溶于足量水中得到不饱和溶液,再向所得溶液中小心滴入100g一定溶质质量分数的AgNO 3溶液(杂质不与AgNO 3溶液反应).实验过程中,生成沉淀的质量与滴入AgNO 3溶液的质量关系如图所示,试计算:
(1)恰好完全反应时生成沉淀的质量是 .
(2)样品中氯化钠的质量是多少?
(3)原硝酸银溶液中溶质质量分数是多少?

将100g氯化钾样品(含有碳酸钾杂质)加入到50g盐酸中,样品完全反应,产生的气体全部逸出,并测得反应后的溶液总质量为145.6g。请计算:
(1)K 2CO 3中K、C、O元素的质量比为 。
(2)产生气体的质量为 g;
(3)样品中氯化钾的质量分数。(写出计算过程,最后结果精确到0.1%)
煤属于不可再生资源,将煤通过一定方式可转化为汽油、乙醇(C 2H 5OH)和气体燃料。乙醇可用作燃料。我国已经推广使用一种车用乙醇汽油,这种汽油的燃烧废气对环境的污染较少,请计算:
(1)69g乙醇完全燃烧,生成二氧化碳的质量为多少?(要求写出计算过程)
(2)在氧气不足的情况下,乙醇不完全燃烧生成一氧化碳、二氧化碳和水,若69g乙醇不完全燃烧生成88g二氧化碳,则反应生成一氧化碳和水的分子个数比为 。