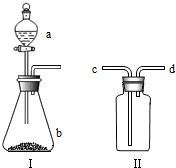
化学课外小组设计了如图一套气体发生收集装置,以探究该装置的多功能性.
(1)甲同学认为装置Ⅰ可作为实验室制取
的发生器,则Ⅰ的
仪器中可加入,
仪器加入,反应的化学方程式为,装置Ⅱ中从管口进气即可作为
的收集装置.
(2)乙同学认为利用装置Ⅰ可作为实验室制二氧化碳的发生器,则Ⅰ中
仪器可加入,
中加入.如果制
则Ⅱ中从管口进气即可收集
.
酸、碱、盐是几类有广泛用途的重要化合物.
(1)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条.
(2)氢氧化钙是一种常见的碱,列举其在生产、生活中的一种用途.
(3)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图)的溶液,他们对此产生了兴趣.
提出问题:这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
①小明根据标签上的组成元素认为一定不可能是 (提示:只有其中一种).
②小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是:
设计实验:为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 |
实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 |
出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 |
白色沉淀全部溶解,并产生大量气泡 |
实验结论:③该瓶无色溶液是 .出现白色沉淀过程的化学方程式是: .
实验反思:④小强认为上述设计实验还可简化,也能达到目的.小强的实验操作是:
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.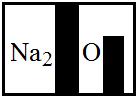
一氧化碳还原氧化铁的装置如图(B中盛有澄清的石灰水),回答问题.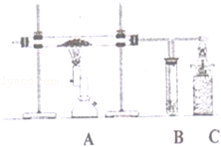
(1)写出A中发生反应的化学方程式.
(2)C装置的作用是
(3)为探究锌、铁、铜的活动性顺序,某同学设计了一组实验:
①锌片浸入稀硫酸中
②铜片浸入稀硫酸中
③锌片浸入硫酸亚铁溶液
请补充一个实验来证明三种金属活动性顺序(写出实验步骤、现象).
结论:锌、铁、铜的活泼性顺序为Zn>Fe>Cu.
酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.
(1)酸和碱的组成中都含有氢元素,如图是氢在元素周期表中的一些信息,下列对图中信息的理解或应用错误的是 .
①A表示氢原子核中含有一个质子②B是元素的符号③C是元素的名称④D是原子的质量
(2)盐酸,硫酸和其他的酸都有相似的化学性质,如:它们都能使酸碱指示剂变色,它们都 ;浓硫酸有 ,故可做干燥剂,但是浓硫酸不能干燥氨气,因为氨气能与硫酸反应,生成硫酸铵.该反应的化学方程式为
(3)氢氧化钠、氯化钙、硫酸铜等物质的水溶液能导电,但是它们的固体缺不能导电,这是为什么?
(4)水垢主要是由氢氧化镁和碳酸钙组成的混合物,同学们分别用稀盐酸和稀硫酸来除去水垢,发现用稀盐酸很快就能将水垢除去,但是用稀硫酸除水垢时,反应会逐渐停止.你认为稀硫酸不能将水垢完全除尽的原因是
(5)为了测定水垢中的碳酸钙的含量,同学们称取10.0g水垢放入烧杯中,分4次将稀盐酸向烧杯中加入,测得数据如下表:
| 未加稀盐酸时 |
第一次加入10.0g稀盐酸 |
第二次加入10.0g稀盐酸 |
第三次加入10.0g稀盐酸 |
第四次加入10.0g稀盐酸 |
|
| 烧杯中物质总质量 |
10.0g |
18.9g |
27.8g |
36.7g |
46.7g |
请计算:①反应生成二氧化碳的质量;②水垢中含有碳酸钙的质量分数.
实验室有一瓶试剂,密封完好但标签残缺,只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小丰和小安同学很感兴趣,决定对其成分进行探究.
提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是
A、酸 B、碱 C、盐
查阅资料:
I、初中化学常见的含钠化合物有NaCl、NaOH、
II、Na2CO3和NaHCO3溶液呈碱性:
III、室温(20°C)时,四种物质的溶解度的数据如下:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度g |
36 |
109 |
215 |
9.6 |
得出结论:小安根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 .
设计实验并继续探究:
(1)小丰用洁净的玻璃棒蘸取该溶液滴在PH试纸上,测得PH>7,这瓶试剂不可能是 .
(2)小丰为了确定该溶液是哪种溶液,他又进行了如下实验:
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 取样于试管中,滴 加 |
产生大量的气泡 |
该溶液是 ,反应的化学方程式 |
小丰为了探究一瓶CaCl2溶液的质量分数,取该溶液50g,加入50gNa2CO3溶液,恰好完全反应,所得溶液质量95g,请你计算所用CaCl2溶液的质量分数?
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.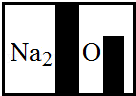
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是 .
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是 .
[设计实验]为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 |
实验现象 |
| (1)取少量样品于试管中,慢慢滴加BaCl2溶液 |
出现白色沉淀 |
| (2)静置一段时间后,倾去上层清液,向沉淀中继续滴加稀盐酸 |
白色沉淀全部溶解,产生大量气泡 |
[实验结论]
(3)该瓶无色溶液是 .生成白色沉淀过程的化学方程式是 .
[实验反思]
(4)小强认为上述设计实验还可简化,仍能达到目的.小强的实验操作是 .
(5)经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐.简述实验操作和现象.
(6)[综合计算]现取含有氯化钠杂质的纯碱样品25g放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为66.2g(不包括烧杯的质量,且气体的溶解忽略不计).试计算纯碱样品中杂质氯化钠的质量分数.