下列说法中正确的是( )
| A.SO2和O3、PO43—和C1O4—互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3—,其碳原子的杂化类型发生了改变 |
| C.CH4、BCl3、CO2都是含有极性键的非极性分子 |
| D.所有元素的基态原子核外电子排布都遵循构造原理 |
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol |
锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如图,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应化学方程式为:
LiCoO2===Li1-xCoO2+xLi。关于该电池的推论错误的是( )。
A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应xLi-xe-===xLi+
C.充电时,将电能转化为化学能
D.充电时,负极(C)上锂元素被氧化
可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )。
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e- ===4OH- |
| B.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-==="Al" (OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:
3Fe2+ + 2S2O32- + O2 + aOH-=" Y+" S4O62- + 2H2O,下列说法中不正确的是
| A.a=4 |
| B.将Y均匀分散到水中形成的体系具有丁达尔效应 |
| C.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol |
| D.S2O32-是还原剂 |
能正确表示下列反应的离子方程式是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ |
| C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ="HClO+" HSO3- |
| D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: |
2Al3++3SO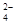 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓