某合金由A、B、C、D 四种元素组成,这四种元素位于周期表中前四周期,A是主要成分元素,A的基态原子中有4个未成对电子。B是第一主要的合金元素,B的含量不低于11%,否则不能生成致密氧化膜BO3防止腐蚀,B与A同周期,且原子核外未成对电子数最多。C位于周期表中第4行、第10列,D的基态原子的最外层电子数是其电子层数的2倍,未成对电子数与电子层数相等。
(1)A的原子结构示意图是 。A的一种晶体的晶胞如图甲,乙图中●和○表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到a~d图中正确的是 。
(2)写出B原子的基态的外围电子排布式_________________,与B同周期且基态原子最外层电子数与B相同的元素,可能位于周期表中的___区和 ___区。
(3)基态D原子的外围电子排布图是 。据报道,只含镁、C和D三种元素的晶体竟然具有超导性。该晶体的结构(如图示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为 。晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有 个。
原子有 个。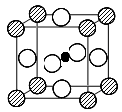
图中:●表示D原子, 表示C原子,
表示C原子, 表示镁原子
表示镁原子
(4)(已知 =1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
=1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
选考[化学—选修物质结构与性质]
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)A、C单质熔点A_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______;
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______;
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。该晶体中阳离子和阴离子个数比为___,晶体中每个Xn-被__个等距离的C+离子包围。
选考[化学—选修化学与技术]
通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之间)代替氟利昂作致冷剂,这一做法对环境的积极意义是。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如图:
①分解池中反应的化学方程式为:。
②合成塔中,若有4.4g CO2与足量H2恰好反应生成气态产物,放出4.947kJ的热量,写出该反应的热化学方程式:。
(3)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积Ksp分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的溶液,实验时除测定温度、压强和空气的体积外,还需测定。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3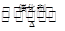 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH="—196.6" kJ/mol ;
2SO3(g) ΔH="—196.6" kJ/mol ;
2NO(g)+O2(g)  2NO2(g)ΔH="—113.0" kJ/mol ;
2NO2(g)ΔH="—113.0" kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g)ΔH 的ΔH=________。
SO3(g)+NO(g)ΔH 的ΔH=________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 |
| D.每消耗1 mol SO3的同时生成1 mol NO2 |
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。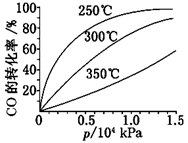
该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______________________。
【化学-选修5有机化学基础】
咖啡酸苯乙酯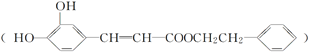 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。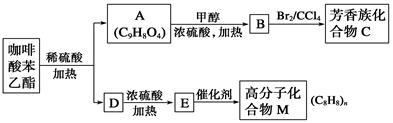
请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)高分子化合物M的结构简式是_______________________________。
(3)写出A→B反应的化学方程式:__________________________________。
(4)A→B的反应类型为__________;E→M的反应类型为________;B→C的反应类型为__________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基 ②能发生银镜反应
③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
【化学-选修3物质结构与性质】(15分)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的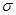 键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有个铜原子。
键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数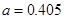 nm,晶胞中铝原子的配位数为。列式表示Al单质的密度g
nm,晶胞中铝原子的配位数为。列式表示Al单质的密度g cm-3。
cm-3。