短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数与D和F原子最外层电子数之和相等;D和E是相邻两种元素。
(1)E元素基态原子的核外电子占用了 个原子轨道;F元素的名称: _。
(2)A和E元素的最高价含氧酸的酸性较强的是__________;(填化学式)
(3)A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物,用离子方程式表示该化合物的水溶液显碱性的原因__ _。
(4)B、C、D三种元素原子半径最大的是 (填元素符号),离子半径最小的是 (填离子符号)。M元素与D元素位于不同主族,但由于二者的电负性相近,导致某些性质相似。将M的最高价氧化物溶于C的氢氧化物的水溶液中,发生反应的离子方程式为
_。
(5)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式 。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显价,A的电负性B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),其中3种离子晶体的晶格能数据如下表: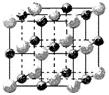
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。
(5)某配合物的分子结构如右图所示,其分子内不含有(填序号)。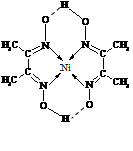
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为▲。(填字母)
A.用冰水混合物B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因▲,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应▲。
表1不同pH下二氧化锗的溶解率
| pH |
4 |
5 |
6 |
7 |
8 |
9 |
| 溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为。
(2)上述反应中产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3— = 2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成48g S,则生成标准状况下的NO2的体积为L。若准确测得的实际体积小于理论值(计算值),请分析可能原因。
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下: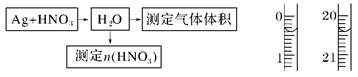
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为。
②测定NO的体积:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中(填“有”或“没有”)NO产生,作此判断的依据是。
已知A、B、E是常见的非金属单质,C是导致酸雨的主要成分之一,Y是生活中常见的金属单质。D、K是重要的无机化工产品。X含有两种元素,具有摇篮式的分子结构,其球棍模型如图所示。H为白色沉淀。下列转化关系中部分反应条件和产物略去。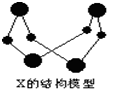
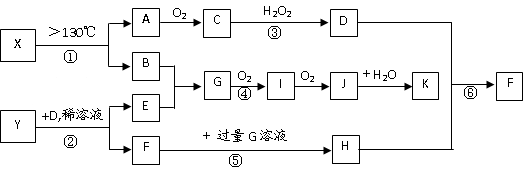
试回答下列问题
(1)X的化学式为: ▲ ;G的电子式 ▲ ;
(2)反应④的化学方程式:▲;
反应③的离子方程式: ▲;
(3)①~⑥反应中属于氧化还原反应的是(填编号) ▲;
(4)已知在真空中,将A与CuO按物质的量1:1反应可生成A2O。写出该反应的化学方程式:▲;
(5)依据实验中的特征实验现象,可确定Y是何种金属,该实验现象为▲。
(16分)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
⑴下列做法有助于能源“开源节流”的是▲(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如右图所示。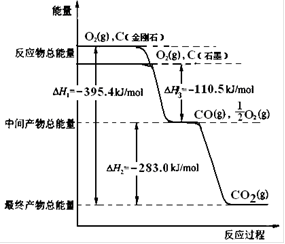
(a)在通常状况下,金刚石和石墨中____▲___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为____▲___ kJ·mol-1。
(b)12 g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量 ▲kJ。
(3)已知:N2(g)+O2(g)=2NO(g);ΔH=+180.0 kJ·mol-1。
综合上述有关信息,请写出CO除NO的热化学方程式▲ 。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。
(4)研究表明,电池的正极用二氧化锰纳米棒为材料可提高发电效率,这是利用纳米材料具有
▲ 特性,能与钠离子充分接触。
(5)海水中的“水”电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池负极反应式为▲;当生成1 mol Na2Mn5O10转移▲ mol电子。