金属材料在生产、生活中有着广泛的应用。
(1)下列应用中使用金属材料的有 ,使用有机合成材料的有 (填字母)。
(2)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
根据实验①判断出镁的金属活动性比铁强,依据的现象是 ;
根据实验②的现象得出的结论是 。
(3)化学小组收集到洗照片用过的硝酸银废液,利用废铁、废锌回收金属银。他们将金属混合物加入到硝酸银废液中,充分反应后过滤,得到固体和浅绿色溶液(忽略其他杂质),为了探究滤液中溶质的可能组成,他们做出以下猜想:
①溶质为硝酸锌 ②溶质为硝酸亚铁和硝酸银
③溶质为硝酸锌、硝酸亚铁 ④溶质为硝酸锌、硝酸亚铁、硝酸银
上述猜想中可能正确的是 。
(4)小组同学继续实验验证所得银粉固体中是否含有铁粉:
甲同学用简单的物理方法证明了固体中含有铁粉。他的方法是 ,
乙同学设计了如下测定固体中含银的质量分数的实验步骤:
A.取两药匙样品,加入过量稀硫酸; B.待充分反应后,取出不溶物;
C.不溶物经洗涤、干燥后称量,记录其质量。
请回答:①步骤B中判断已充分反应的依据是 ;
②乙同学设计的实验方案能否达到实验目的,请说明理由 , 。
化学小组在做实验时,不小心将固体食盐中混入了氢氧化钠,但不知是否又混入了氢氧化钙和碳酸钙中的一种或两种,请按要求回答问题:
(1)确定成分:
| 实验操作 |
实验现象 |
实验结论 |
| 没有混入碳酸钙 |
||
| 混入了氢氧化钙 |
(2)除去杂质:
①将余下的固体药品放入大烧杯中并向其中加入足量的蒸馏水,使其完全溶解,再向烧杯中加入过量的,目的是,最后进行过滤。
②向实验①所得的滤液中加入过量的。
③将实验②所得的溶液采用的方法,便可以得到纯净的食盐固体。
为了检验含二氧化碳的废气中混有一氧化碳,用下图所示装置进行实验。其中,A和E中的液体是氢氧化钠溶液;B和D中的液体是澄清的石灰水,试回答:
(1)当观察到时,说明混合气体中一定混有一氧化碳。
(2)装置C中发生反应的化学方程式是 。
(3)装置B的作用是;装置E的作用是,该装置中发生反应的化学方程式是。
根据下列实验装置图回答: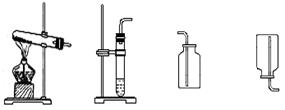

A B C D E
(1)实验室加热高锰酸钾制氧气的发生装置应选用的是;反应的化学方程式是。用过氧化氢和二氧化锰制氧气的化学反应的方程式是;收集若选用装置E,则气体应由(填导管口代号)进入集气瓶。
(2)验证二氧化碳与水能反应若选用装置E,则气体应由(填导管口代号)进入集气瓶,装置E内所选择的试剂是。
某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液和白色固体:
(1)上述过程中发生反应的化学方程式为。
(2)我的推测是:该溶液中一定存在的溶质是。
(3)为进一步确定该溶液所有可能的组成,同学们设计了如图所示的实验装置进行验证。
①甲装置中发生反应的化学方程式为。
②关闭止水夹b,打开止水夹a,若观察到乙装置出现浑浊现象,则滤液中的溶质有。
③关闭止水夹a,打开止水夹b的实验目的是,预测的实验现象为。
④打开a和b,(填写现象和结论)。
某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按下图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕。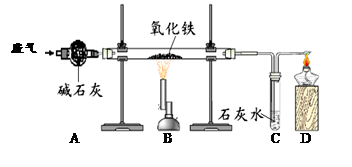
(1)A中碱石灰的作用是___________________________。
(2)B中发生反应的化学方程式是______________________________________。
(3)该实验能证明混合气体中存在CO的现象是。
(4)若反应前称得硬质玻璃管内的氧化铁质量为10克,反应一段时间后冷却再次称量发现硬质玻璃管内的固体质量变为7.6克,则反应了的氧化铁的质量分数为____________。