氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.N原子的电负性比C原子强 |
等物质的量的下列金属分别跟足量盐酸反应,同温同压下产生氢气体积最大的是
| A.钠 | B.铝 | C.镁 | D.铁 |
某溶液中含有HCO3-、Na+、Ba2+、NO3-等4种离子,若向其中加入少量的Na2O2固体后溶液中离子浓度基本保持不变的是
| A.HCO3- | B.NO3- | C.Ba2+ | D.Na+ |
下列说法中正确的是
| A.胶体区别于其他分散系的本质特征是丁达尔现象 |
| B.将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热,以制取Fe(OH)3胶体 |
| C.Fe(OH)3胶体粒子在电场影响下将向阴极运动,说明Fe(OH)3胶体带正电 |
| D.往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现凝聚,再继续逐滴加时,沉淀又会消失 |
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:根据表中数据判断,其中不能形成合金的是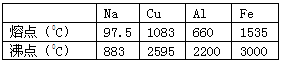
| A.Cu和Al | B.Fe和Cu | C.Fe和Na | D.Al和Na |
在无色透明溶液中可以大量共存的离子组是
| A.H+ Na+ S2- CO32- | B.H+ Ca2+ MnO4 NO3 NO3 |
C.K+Ca2+ Cl HCO3 HCO3 |
D.Cl Mg2+ Al3+ OH- Mg2+ Al3+ OH- |