(15分)A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、D同主族,B、C同周期,C、F最外层电子数相等,F的质量数为C的2倍,元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体。B、C、F的质子数之和等于E、G的质子数之和。
(1)由A、B、C、D四种元素组成的一种常见化合物乙是__________________(填写化学式);(2分)
(2)由C、D、E三种元素组成的一种化合物丙是____________(填写化学式);(2分)
(3)G单质与水反应的离子方程式为_________________________________________;(3分)
(4)书写甲的电子式____________________________(2分)
(5)A2C和A2F中,沸点较高的是 (填化学式)(1分),
液态A2C汽化需要破坏微粒间的作用是______________________(2分)
(6)少量甲通入丙溶液中的离子方程式是__________________________________;(3分)
(12分)已知D是单质,其他均是常见 的化合物,它们之间的转化关系如下图所示,
的化合物,它们之间的转化关系如下图所示,
其中M(A)<M(B)。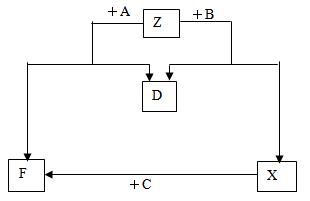
回答下列问题:
(1) 符合此转化关系的A、C的化学式分别是:A______________、C______________。
(2) 写出B的电子式:_______________,Z中阴阳离子数之比为:_____________。
(3) 若向X的水溶液中滴加几滴酚酞试液,现象是,
出现此现象的原因用离子方程式表示为,然后再加入足量的BaCl2溶液,出现的现象是,
原因是。
(4) 室温下,将2g苯和过量的D混合,完全燃烧,放出83.6kJ的热量,写出苯燃烧热的热化学方程式____________________________________________________。
请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一 个未配平的化学方程式。
个未配平的化学方程式。
(1)_________+__________ → __________+__________+__________+H2O
(2)反应物中发生氧化反应的物质,被还原的元素是。
(3)反应中1 mol氧化剂(填“得到”或“失去”)mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I一。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加 HCl 后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加 CCl4,滴加少量氯水,振荡后, CCl4层未变色;
④加 BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀能完全溶解;
⑤加 HNO3酸化后,再加过量 AgNO3,溶液中析出白色沉淀。
(1)分析上述 5 个实验,写出每一实验鉴定离子的结论与理由。
实验①;
实验②;
实验③;
实验④ ;
;
实验⑤;
(2)上述 5 个实验不能确定是否存在的离子是。
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的: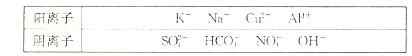
为了鉴别上述化合物。分别完成以下实验,其结果是:
①、将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②、将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③、进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④、在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体, C、D中产生
C、D中产生 白色沉淀;
白色沉淀;
⑤、 将B、D两溶液混合,未见沉淀或气体生成.
将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)、写出B、D的化学式:B(2分),D (2分)。
(2)、将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为(2分)。
(3)、在A溶液中加少入量澄清石灰水,其离子方程式为(2分)。
(4)、C常用作净水剂,用离子方程式表示其净水原理(2分)。
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。臭氧分子的结构如图,呈V型,两个O-O键的夹角为116.5º,三个原子以一个O原子为中心,与另外两个氧原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学健―三个O原子均等地享有这4个电子。(如图所示)。请回答:
(1)臭氧与氧气的关系是______________。
(2)选出下列 分子与O3分子的结构最相似的是
分子与O3分子的结构最相似的是
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)O3具有强氧化性,它能氧化PbS为PbSO4,而O2不能,试配平:
_____PbS + _____O3 ——_____PbSO4 + _____O2