[化学一选修2:化学与技术](15分)已知:
①工业上用硫酸与 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
请回答:
(1)沉淀Y的主要成分的化学式是____________。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其使用的原因____________
(3 )操作1涉及的实验方法是__________________。
(4 )写出用铝粉还原法制取金属锂的化学反应方程式。________________________
(5) LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是__________________
(6) 目前电池通常使用金属锂的优点是__________________
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式
(4)化合物乙的电子式
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是
SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的化学方程式是 。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3):V(NaOH)= 。
② NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验):
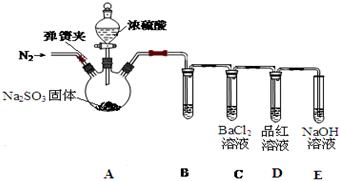
已知:Na2SO3(固体) + H2SO4(浓)  Na2SO4 + SO2↑+ H2O
Na2SO4 + SO2↑+ H2O
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
① A中产生的白雾是浓硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
② 。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 。
④通过甲乙两位同学的实验,得出的结论是 。
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。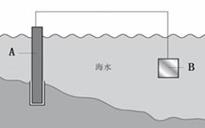
图1
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。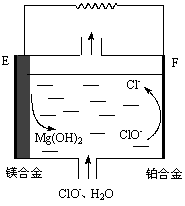
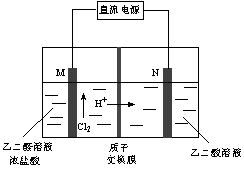
图2图3
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知: 生成氢氧化物沉淀的pH
| Mn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
|
| 开始沉淀时 |
8.3 |
6.3 |
2.7 |
4.7 |
| 完全沉淀时 |
9.8 |
8.3 |
3.7 |
6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 。盐酸溶解MnCO3的化学方程式是 。
(2)向溶液1中加入双氧水时,反应的离子方程式是 。
(3)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□_______=□_______+□_______+□_______。
(4)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是 。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 。
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示: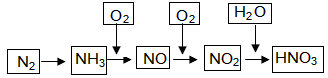
请回答:
(1)NO2与H2O反应中的还原剂是______________。
(2)NH3与O2制取NO的化学反应方程式_________________。
(3)下列说法不正确的是(选填序号字母)_________________。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标况下,该浓硝酸与足量铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为___________。
(5)已知:
①H2(g)+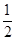 O2(g)=H2O(g)△H1=-241.8kJ/mol,
O2(g)=H2O(g)△H1=-241.8kJ/mol,
②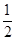 N2(g)+O2(g)= NO2(g) △H2=+33.9kJ/mol,
N2(g)+O2(g)= NO2(g) △H2=+33.9kJ/mol,
③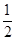 N2(g)+
N2(g)+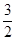 H2(g)=NH3(g)△H2=-46.0kJ/mol
H2(g)=NH3(g)△H2=-46.0kJ/mol
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H=___________kJ/mol。