三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:___________________________
假设3:__________________________________ (此两空填在答题卡上)
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? ,简述你的理由(不需写出反应的方程式 )
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的主要离子方程式
【探究延伸】经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
(5)某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,请设计一简单实验,确定该矿物中含有+2价的铁(写出所用试剂,操作方法和结论)。
CoCl2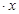 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2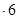 H2O的一种新工艺流程如下图:
H2O的一种新工艺流程如下图: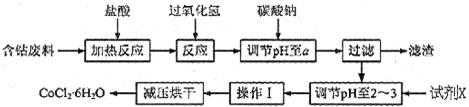
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2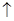
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
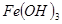 |
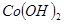 |
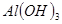 |
| 开始沉淀 |
2.3 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.2 |
5.2 |
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:__________
(2)加入碳酸钠调节pH至a,a的范围是__________;
(3)最合适的试剂X是__________
(4)操作I包含3个基本实验操作,它们是__________、__________和减压过滤。
(5)制得的CoCl2·6H2O需减压烘干的原因是__________。
实验和探究对化学学科的发展起着非常重要的作用
(1)写出下列实验过程中所体现的总的离子反应方程式:
①用PH试纸测得醋酸钠溶液呈碱性:__________
②用石墨做电极,电解硝酸银溶液后,溶液呈酸性:__________
③根据浑浊出现的快慢,探究硫代硫酸钠与酸反应速率的影响因素:__________
(2)已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6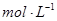 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为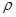 ,则h=__________
,则h=__________
(3)实验室测定绿矾中FeSO4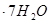 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有: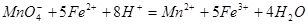
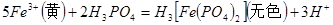
①绿矾的含量为__________%。
②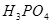 的作用是__________。
的作用是__________。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式。
(2)饱和碳酸钠溶液的主要作用是。
(3)浓硫酸的作用是与。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
(1) 写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
_________________________________;_________________________________
(2) 安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象______________________________。
(3) 容器c中NaOH溶液的作用是________________________________。
(4) 某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因:
① ___________________________________________________________;
② ___________________________________________________________
实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液。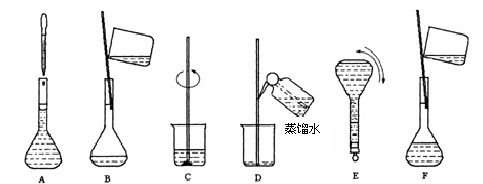
(1)需称量___________g烧碱,应放在_____________(填仪器名称)中称量
(2)配制过程中,不需要的仪器(填写代号)____________________
a、烧杯 b、量筒 c、玻璃棒 d、1000mL容量瓶 e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是____________,___________,________。
(4)步骤B通常称为转移,步骤A通常称为
(5)将上述实验步骤A到F按实验过程先后次序排列
(6)在容量瓶中确定溶液体积的过程中,最后加入少量水的操作是______________________