【化学—选修5:有机化学基础】(15分)
卤代烃在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。设R为烃基,已知: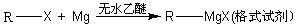

某有机物A有如下转化关系: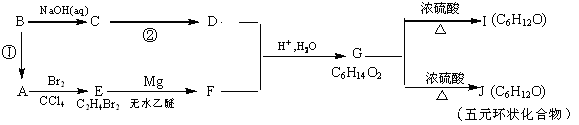
试回答下列问题:
(1)反应①的反应试剂和实验条件是
(2)C→D的化学反应方程式为 ;反应类型是 ;
(3) G的结构简式是___ ,G的最简单的同系物的名称是
(4)I中所含官能团的名称是
(5)分子式与I、J相同,但能发生银镜反应的异构体有 种。写出其中含—CH3个数最多的异构体的结构简式
A~H等8种物质存在如下转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题: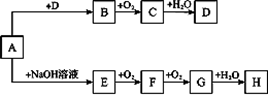
(1)写出下列物质的化学式:A,B。
(2)写出下列反应的化学方程式:E→F;
写出下列反应的离子方程式:A→E;
H的浓溶液与木炭反应的化学方程式:。
(3)检验某溶液中是否含D中阴离子的方法是。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: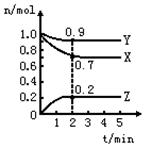
(1)该反应的化学方程式。
(2)反应开始至2min,以气体Z表示的平均反应速率为。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时_______(填“增大”“减小”或“相等”)。
(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a |
|||||||
| b |
c |
d |
|||||
| e |
f |
g |
(1) f元素在周期表中的位置是第周期第族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_____________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
已知反应:3NO2+H2O==2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为。
(2)氧化剂与还原剂的质量比为,氧化产物与还原产物的物质的量之比为。
(3)在标准状况下,3.36L NO2与H2O完全反应转移的电子数目为。
(4)写出HNO3与石灰水反应的离子方程式。
现有①BaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤干冰 ⑥碘⑦二氧化硅晶体七种物质,按下列要求回答(将物质的序号填入下列空格中):
(1)属于原子晶体的化合物是_____________。
(2)固态时属于分子晶体的是____________。
(3)熔化时需要破坏共价键的是___________,熔点最低的是___________。
(4)既含有离子键又含有共价键的是__________。