某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: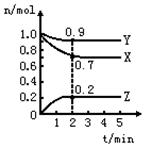
(1)该反应的化学方程式 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时_______(填“增大”“减小”或“相等”)。
按要求填写下列空白
(1)含有一个手性碳原子且式量最小的单烯烃的结构简式。
(2)若分子式为C4H6的某烃中所有的碳原子都在同一直线上,则该烃的结构简式_。
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为。
(4)不能使酸性高锰酸钾溶液褪色的相对分子质量最小的苯的同系物的结构简式_。
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
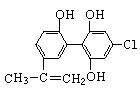
①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是
| A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 |
| B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 |
| C.两种兴奋剂最多都能和含3molNaOH的溶液反应 |
| D.两种分子中的所有碳原子均不可能共平面 |
煤和石油是重要的能源,也是化工生产的重要原料。
(1)工业上分馏石油的设备是________,通过该设备制备出的液体燃油有__________________________。
(2)使用催化剂进行石油裂化及裂解获得的主要产品是_____________________________。
(3)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______ _____________________。
(4)下图是对煤燃烧产生的废气进行常温脱硫处理的流程示意图。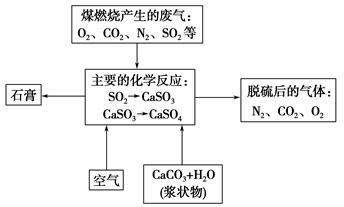
①废气脱硫过程中,主要反应的化学方程式为__________________________、__________________________。
②在煤中直接添加一种物质,可有效减少煤燃烧产生的SO2,该物质是_________________________。
③石膏在工业生产中的用途是________(写出一种用途即可)。
(5)煤经过________(填加工方法)可以得到炉煤气、煤焦油和焦炭。煤焦油经过________(填加工方法)可得到芳香族化合物。煤也可以用氢化法转化成燃油,氢化法的本质是___________________________。
水处理技术在生产、生活中应用广泛。
(1)含有较多________离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为____________(写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过________(填“RH”或“ROH”)型离子交换树脂,原因是__________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为____________。电渗析法净化水时,使离子通过半透膜的推动力是__________。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的__________。
作为国家正在实施的“西气东输”工程终点站——上海将逐步改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。
(1)目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民
开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量
烃类,天然气的主要成分是CH4,它们燃烧的化学方程式为:
2CO+O2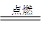 2CO2 2H2+O2
2CO2 2H2+O2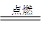 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 ,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是 。
(2)管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质如下:
| 乙烷 |
丙烷 |
丁烷 |
|
| 熔点/℃ |
-183.3 |
-189.7 |
-138.4 |
| 沸点/℃ |
-88.6 |
-42.1 |
-0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是___________________________。