钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减小环境污染。请填写下列空白: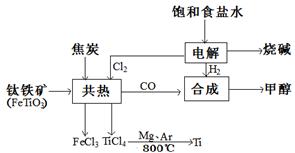
(1)电解饱和食盐水时,该反应的离子方程式是____________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);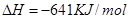
②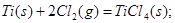
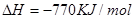
则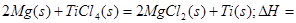 ____________
____________
反应: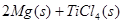
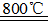
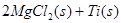 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________
(3)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式______________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时正极区溶液的PH_____(填“增大”、“减小”或“不变”)该电池中负极上的电极反应是__________.
(5)在上述产业链中合成96t甲醇理论上消耗H2_________t(不考虑生产过程中物质的任何损失)
甲酯除草醚是一种光合作用抑制剂,能被叶片较快地吸收,但在植物体内传导速度较慢,它是芽前除草剂,主要用于大豆除草等。工业上通常用烃A进行合成,其合成路线如下: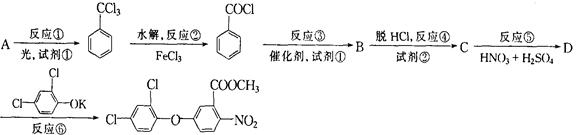
已知: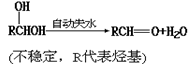
(1)试剂①为:_______________,试剂②为________________。
(2)写出A的结构简式。
(3)写出下列反应的化学方程式:
反应①。
反应⑤。
(4)由于苯环和侧链基团的相互影响,新引进苯环的基团在苯环上取代的位置由原有基团决定,如:苯酚分子中“—OH”使苯环上_________(选编号填空,下同)的H原子容易被取代;根据题目信息可知“—COCl”使苯环上________的H原子容易被取代。
a.邻位 b.间位 c.对位
(5)反应②须在饱和FeCl3溶液中进行,若在NaOH溶液中进行,则会进一步水解,试写出在
足量NaOH溶液中完全水解的化学反应方程式___________________
从含铜、银、金和铂的块状金属废料中提取铂、金、银的一种工艺如下: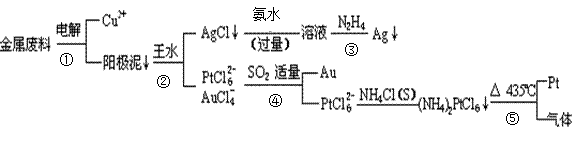
根据以上工艺回答下列问题:
(1)电解时,以_____________为阳极,纯铜为阴极,CuSO4溶液为电解液,则阴极的电极反应方程式为
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
(3)写出步骤④的离子方程式:
(4)金和浓硝酸反应的化学方程式为:Au +6HNO3(浓) Au(NO3)3+3NO2↑+ 3H2O,因该反应正向进行的程度极小,所以金几乎不溶于浓硝酸,但金却可以溶于王水,试简要解释之:
Au(NO3)3+3NO2↑+ 3H2O,因该反应正向进行的程度极小,所以金几乎不溶于浓硝酸,但金却可以溶于王水,试简要解释之:
(5)写出反应⑤的化学反应方程式
____________________________________________________________________________
短周期元素A、B、C、D在周期表中的位置如下图所示,回答下列问题:
| A |
B |
C |
| D |
(1)设A、B、C、D四种元素的原子序数之和为M,则M____________。
A.必为奇数B.必为偶数C.可能为奇数,也可能为偶数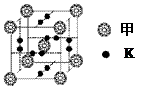 (2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
(2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
①D的元素符号为____________;
②B形成的一种单质分子(甲)可以和钾“掺杂”
在一起制造出化合物乙,其晶胞如右图所示,则该晶
体中甲分子和钾原子的个数比为 ;
(3)若D元素原子的次外层电子数等于其它各层电子数之和,则:
①用电子式表示D元素氢化物的形成过程 ;
②过量A元素的氢化物与D元素最高价氧化物对应水化物反应生成化合物Z,则 Z的水溶液中所有离子的浓度由大到小的顺序为 ;
Z的水溶液中所有离子的浓度由大到小的顺序为 ;
③用上述某元素的氢化物X与另一元素的氧化物Y反应,可生成一种强酸,则X、Y可能为:
和 ,或 和 (填分子式)。
如图所示,将等物质量的Cl2和CH4充入一容积为25 mL 的量筒,并将量筒倒置在盛有饱和食盐水的水槽中,用日光散射,可观察到的现象是: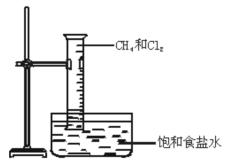
(1);
(2);
(3)。
在烃的分子结构中,每减少2个氢原子,则碳碳间便增加一对共用电子。已知分子组成为CnH2n+2的烃分子中碳碳间的共用电子对数为 n – 1,则化学式为CnH2n-2的烃分子结构中,碳碳间的共用电子对数为,Cx 也可视为烃脱氢后的产物,则C60中碳碳间的共用电子对数为;若某碳单质分子中碳碳间的共用电子对数为 140 ,则该单质的分子式为。