将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
| A.2v(NH3)= v(CO2) |
| B.密闭容器中气体的总物质的量不变 |
| C.密闭容器中混合气体的密度不变 |
| D.密闭容器中二氧化碳的体积分数不变 |
将氨基甲酸铵晶体置于特制的密闭真空容器中(假设容器体积不变,固体体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ()
2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ()

| A.单位时间内生成1 mol CO2的同时消耗2 mol NH3 |
| B.形成6个N—H键的同时有2个C=O键断裂 |
| C.容器中CO2与NH3的物质的量之比保持不变 |
| D.混合气体的密度不再改变的状态 |
对反应A+2B = 4C+3D,以下化学反应速率的表示中,所表示反应速率最快的是( )
A.v (A)=0.40mol•L-1•s-1 B.v (B)=0.50mol•L-1•s-1
C.v (C)=0.36mol•L-1•s-1 D.v (D)=0.30mol•L-1•s-1
下图是可逆反应X + Y  Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是()
Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是()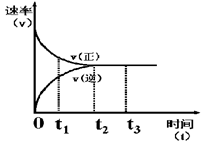
| A.t1时,正反应速率大于逆反应速率 |
| B.t2时,达到该条件下的最大反应限度 |
| C.t2- t3,反应不再发生,各物质的浓度相等 |
| D.t3后,该反应的反应限度有可能被外界条件改变 |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为得出的结论不正确的是( )
| A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,两者速率一样大 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同 |
下列叙述正确的是()
| A.碱金属单质在空气中燃烧的生成物都是过氧化物 |
| B.少量的碱金属单质都能保存在煤油中 |
| C.HF、HCl、HBr、HI的稳定性、还原性从左到右依次减弱 |
| D.随着原子序数的递增,卤素单质的颜色由浅到深,熔沸点逐渐升高 |