(1)题每空1分,其余每空2分,共12分)物质A是化合物,B、C、D、K都是单质,反应②~⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: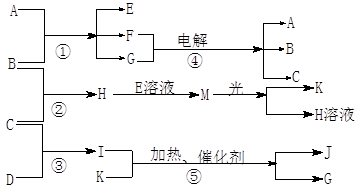
请填写下列空白:
(1)写出下列物质的化学式:B ; C ; D ;
K ;G ;J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
有一无色透明溶液,欲确定是否含有下列离子: K+、Mg2+、A13+、Ba2+、NO3--、SO42-、CI--、Fe2+ HCO3--.取该溶液实验如下:
| 实验步骤 |
实现现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCI2溶液 |
有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是,溶液中肯定不存在的离子是。
(2) 写出(3)中生成沉淀的离子方程式。
写出(5)中沉淀部分溶解的离子方程式。
(3)为进一步确定其他离子.应该补充的实验及 对应欲检离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细操作步骤);
在淀粉-KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,这是因为⑴___________________________,离子方程式:____________________________;⑵在上述蓝色溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,这是因为_______________,离子方程式是__________________________________。⑶从以上实验可知ClO-、I2、SO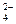 的氧化性由强到弱的顺序是________________________。
的氧化性由强到弱的顺序是________________________。
根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中
进行反应和测定中和反应的反应热。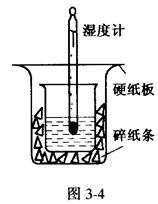
(1)图3-4装置缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________
(填“相同”或“不相同”)。
有一无色透明溶液,欲确定是否含有下列离子: K+、Mg2+、A13+、Ba2+、NO3--、SO42-、CI--、Fe2+ HCO3--.取该溶液实验如下:
| 实验步骤 |
实现现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCI2溶液 |
有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是 ,溶液中肯定不存在的离子是 。
(2) 写出(3)中生成沉淀的离子方程式 。
写出(5)中沉淀部分溶解的离子方程式 。
(3)为进一步确定其他离子.应该补充的实验及 对应欲检离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细操作步骤) ;
已知A、B、C、D分别是Na2SO3、HCl、BaCl2、AgNO3四种物质的水溶液中的某一种,将它们两两混合反应的情况如下:
注:↓表示生成沉淀,↑表示生成气体,/表示不反应。
| A |
B |
C |
D |
|
| A |
↓ |
↓ |
∕ |
|
| B |
↓ |
↓ |
↑ |
|
| C |
↓ |
↓ |
↓ |
|
| D |
∕ |
↑ |
↓ |



 ①写出A、B、C、D的化学式A B C D
①写出A、B、C、D的化学式A B C D ②写出A与C反应的离子方程式
②写出A与C反应的离子方程式 写出B与D反应的离子方程式
写出B与D反应的离子方程式