乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)已知 2CH3CHO+O2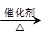 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。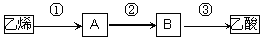
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________,反应类型是__________________。
①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp [Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为。
(2)25℃时,HF电离常数的数值Ka ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。
(3)25℃时,向浓度均为0.1 mol·L-1的相同体积的HF和醋酸两种溶液中分别加入相同的足量锌粒,初始时产生氢气的速率关系为(填“>”“=”或“<”,下同)。反应结束后,产生氢气的物质的量的关系为,两溶液中c (F-)c (CH3COO-)。
(4)25℃时,4.0×10-3mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g)  pC(g)+qD(g)。
pC(g)+qD(g)。
已知:平均反应速率vC=1/2vA;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。
回答下列问题:
(1)化学方程式中,x=、y=、p=、q=;
(2)反应2min内,vA =;
(3)反应平衡时,D为 2amol,则B的转化率为;
(4)已知该反应在不同温度下的平衡常数如下:
| 温度℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
该反应的平衡常数表达式K=_____________,ΔH ________0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率(填“增大”、“减小”或“不变”) ;
②平衡时反应物的转化率(填“增大”、“减小”或“不变”),理由是
。
请将氧化还原反应:2Fe3++2I- 2Fe2++I2设计成带盐桥原电池。
2Fe2++I2设计成带盐桥原电池。
试剂:FeCl3溶液,KI溶液;其它用品任选。
请回答下列问题。
(1)请画出设计的原电池装置图,并标出电极材料,电极名称及电解质溶液。
(2)发生还原反应的电极为电池的极,其电极反应式为。
(3)反应达到平衡时,外电路导线中(填“有”或“无”)电流通过。
(4)平衡后向FeCl3溶液中加入少量FeCl2固体,当固体全部溶解后,则此溶液中电极变为(填“正”或“负”)极。
(5)请设计简单实验,证明溶液中同时存在Fe3+、Fe2+。
向10 0mLBa(OH)2溶液中加
0mLBa(OH)2溶液中加 入过量的NaHCO3溶液生成BaCO3沉淀,过滤,将沉淀置于过量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应并收集到1.12L(标准状况下)气体。
入过量的NaHCO3溶液生成BaCO3沉淀,过滤,将沉淀置于过量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应并收集到1.12L(标准状况下)气体。
(1)Ba(OH)2与过量的NaHCO3溶液反应的化学方程式。
(2)生成BaCO3沉淀的质量__________g。
(3)100mL Ba(OH)2溶液中溶质Ba(OH)2的物质的量浓度__________mol/L。
(4)最初加入的NaHCO3溶液中含NaHCO3的物质的量__________mol。
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的500mL稀H2SO4溶液的操作,请按要求填空:
(1)所需浓H2SO4的体积为mL。
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配 溶液浓度将(偏高、偏低、无影响)。
溶液浓度将(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL蒸馏水的里,并不断搅拌。
(4)将冷却至室温的上述溶液沿注入中,并用蒸馏水洗涤烧杯2~3次,洗涤液也要注入其中,并摇匀。
(5)加水至距刻度线下cm时,改用加水,使溶液的凹液面正好跟刻度相切。