已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3  Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下 装置(填序号)。简述该装置能随关随停的理由 。
(2)为使实验能够进行,在B方框内内应选用上图中的 装置(填写序号),该装置内应装入的试剂是 。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是 。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为 (产率为实际产量占理论产量的百分比)。
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中试管内盛放的物质是Ca(OH)2、NH4Cl固体。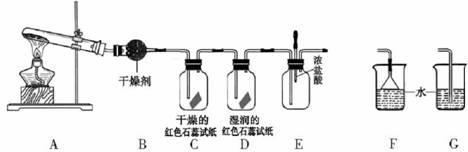
【实验探究】
(1)A中发生反应的化学方程式为。
(2)B中盛放的干燥剂为,干燥氨气能否用浓硫酸(填“能”或“不能”)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是L
(4)实验室收集氨气的方法是。
(5)C、D装置中颜色会发生变化的是(填“C”或“D”),红色石蕊试纸变成色。
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是(填“F”或“G”)。
(1)二氧化硫是无色有刺激性气味的有毒气体,它是一种酸性氧化物。在加热条件下,铜与浓硫酸反应能生成二氧化硫,有关化学方程式为:Cu + 2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O,某课外活动小组设计了如图所示实验装置,进行铜与浓硫酸的反应。
CuSO4 + SO2↑+ 2H2O,某课外活动小组设计了如图所示实验装置,进行铜与浓硫酸的反应。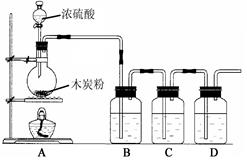
①装置B是二氧化硫气体的收集装置,请在图中补上导气管。
②NaOH溶液的作用是________________________________。
有关反应的离子方程式是:______________________________。
(2)为认识浓H2SO4的强氧化性,老师在B、C、D试剂瓶中依次分装酸性KMnO4溶液、品红溶液、澄清石灰水,进行下图所示的实验。
①你预计反应中浓H2SO4中硫元素的化合价应(填“升高”或“降低”)
②若B中酸性KMnO4溶液紫色变浅,说明A中反应的生成物之一具有性。
③老师提醒同学们,如果把B、D顺序对调,即使澄清石灰水变浑浊也不能说明木炭已被氧化成CO2其原因是 : (用化学方程式表示)。
现用盐酸标准溶液来测定NaOH溶液的浓度。滴定时有下列操作:
①向溶液中加入1~2滴指示剂。
②取20.00 mL标准溶液放入锥形瓶中。
③用氢氧化钠溶液滴定至终点。
④重复以上操作。
⑤配制250 mL盐酸标准溶液。
⑥根据实验数据计算氢氧化钠的物质的量浓度。
(1)以上各步中,正确的操作顺序是________________________________(填序号),上述②中使用的仪器除锥形瓶外,还需要_____________,使用________作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如下表:
| 滴定次数 |
1 |
2 |
3 |
4 |
| V(标准溶液)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)/mL(初读数) |
0.10 |
0.30 |
0.00 |
0.20 |
| V(NaOH)/mL(终读数) |
20.08 |
20.30 |
20.80 |
20.22 |
| V(NaOH)/mL(消耗) |
19.98 |
20.00 |
20.80 |
20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为
V(NaOH) =  mL =" 20.02" mL
mL =" 20.02" mL
他的计算合理吗?。理由是。
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如下图所示,则a 20.02(填“>”“<”或“=”)。
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值。通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该组同学设计了如下滴定方法测定x的值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到反应终点时消耗了10.00mL;
请回答:
(1)滴定时,将KMnO4标准溶液装在图中的(选填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是。
(3)通过上述数据,可计算出x=。
(4)若滴定终点时俯视滴定管刻度,则由此测得的x值会(选填“偏大”、“偏小”或“不变”,下同)。若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会。
化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.
回答下列问题:
(1)A装置中分液漏斗盛放的物质是_________,写出有关反应的化学方程式__________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响?__________________________.有学生认为在E后应再加一与E相同的装置,目的时_______________________
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为______________.
(6)要确定该有机物的化学式,还需要测定________________________.