掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
⑴写出下列仪器的名称: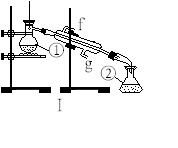
①____________;②____________;④____________;
⑵仪器①~④中,使用时必须检查是否漏水的有__________ 。(填序号)
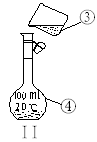
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有________________,将仪器补充完整后进行的实验操作的名称为;_________________ 。现需配制250 ml 0.2 mol/L NaCL溶液,装置II是某同学转移溶液的示意图,图中的错误是__________________
__________________________________________________________________(指出两处)。
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:
①取维生素C样品研碎,称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水硫酸铜和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
②将少许研碎的维生素C样品和适量的紫色石蕊试液充分混合后,溶液颜色变红。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是mo1;碳元素的质量是g。
(2)维生素C中(填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知。如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是。
(4)维生素C和紫色石蕊试液混合后,溶液颜色变红,说明维生素C溶液具有(填“酸”、“碱”或“中”)性。查阅有关资料显示,维生素C具有还原性。请以淀粉溶液、碘水为试剂,写出验证维生素C具有还原性的实验方法和现象:。
含苯酚的工业废水的方案如下图所示: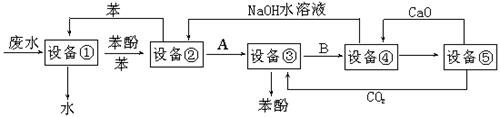
回答下列问题:
(1)设备①进行的是操作(填写操作名称),实验室这一步操作所用的仪器是。
(2)由设备②进入设备③的物质A是。
(3)在设备③中发生反应的化学方程式为。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
某化学课外小组用下图装置制取纯净的溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭)。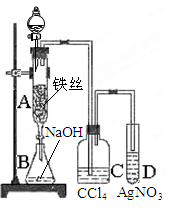
(1)写出A中反应的化学方程式。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关的化学方程式。
(3)C中盛放CCl4的作用是。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,现象是。
I下列实验操作或对实验事实的描述中正确的是_______________
①石油的分馏实验必须将温度计的水银球插入反应液中,测定反应液的温度,其中冷凝管起到冷凝回流的作用
②将0.1mol•L﹣1的NaOH溶液与0.5mol•L﹣1的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基
③不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
④配制银氨溶液:在一定量AgNO3溶液中滴加过量氨水即可
⑤分离苯和苯酚的混合液,加入少量浓溴水,过滤
⑥将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子.
II某校学生为探究苯与溴发生反应的原理,用如图装置进行实验.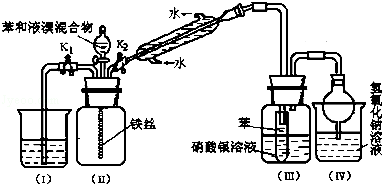
根据相关知识回答下列问题:
(1)实验开始时,关闭K1,开启K2和分液漏斗活塞,滴加苯和液溴的混合液,反应开始.过一会儿,在(Ⅲ)中可能观察到的现象是____________________________________
(2)整套实验装置中能防止倒吸的装置有________________(填装置序号).
(3)反应结束后要使装置(I)中的水倒吸入装置(Ⅱ)中.这样操作的目的是______________________
(4)你认为通过该实验后,有关苯跟溴反应的原理方面能得出的结论是_______________________
(每空2分,共12分)实验室以草酸(HOOC—COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
步骤1:在上图所示装置中,加入无水草酸45g,无水乙醇81g,苯200mL,浓硫酸10mL,搅拌下加热68-70℃回流共沸脱水。
步骤2:待水基本蒸完后,分离出乙醇和苯。
步骤3:所得混合液冷却后依次用水、饱和碳酸氢钠溶液洗涤,再用无水硫酸钠干燥。
步骤4:常压蒸馏,收集182-184℃的馏分,得草酸二乙酯57g。
(1)步骤1中发生反应的化学方程式是,反应过程中冷凝水应从(填“a”或“b”)端进入。
(2)步骤2操作为。
(3)步骤3用饱和碳酸氢钠溶液洗涤的目的是。
(4)步骤4除抽气减压装置外所用玻璃仪器有蒸馏烧瓶、冷凝管、接液管、锥形瓶和。
(5)本实验中,草酸二乙酯的产率为。