实验室有一瓶无色溶液,标签模糊,依稀可见
.为探究该溶液中是否有硫酸根,化学兴趣小组的同学设计以下甲、乙方案,并取样品实验、记录相关现象.

请根据上述信息,完成下列问题:
(1)方案甲得出的结论是:不能确定无色溶液中是否含有硫酸根.理由是.
(2)方案乙得出的结论是:无色溶液中含有硫酸根.则加入足量稀
的作用是;如果加入稀
有气泡产生,则可能发生反应的化学方程式是。(写1个)
(3)另取无色溶液少许,滴入紫色石蕊试液,溶液变红.若溶液中只含有一种阳离子,则方案乙中产生白色沉淀的化学方程式为。
下表是KNO3、NaCl在不同温度下的溶解度(单位:g).
| 温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| KNO3 |
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
| NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
(1)以上两物质溶解度的变化受温度影响较小的是________.
(2)30℃时,KNO3的溶解度是________g.
(3)KNO3溶液中含有少量NaCl时,可通过________的方法提纯.
(4)对(3)析出的晶体和剩余溶液描述正确的是________(填写编号).
Ⅰ.剩余溶液一定是KNO3的饱和溶液
Ⅱ.剩余溶液一定是NaCl的不饱和溶液
Ⅲ.上述方法可以将两者完全分离
Ⅳ.析出的晶体中只含有KNO3
(5)在一定温度下,将含69g KNO3、18g NaCl的混合物完全溶解在50g水中.改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是________(硝酸钾和氯化钠溶解度互不影响).
图是氯化钠和硝酸钾两种固体物质的溶解度曲线.
某兴趣小组为了研究NaCl和KNO3的溶解和结晶,做了两组实验(室温下),其过程如下:
[第一组]
[第二组]
(1)①中溶质的质量分数为________________,⑨的现象是________________.
(2)第一组实验中操作a为________,所得氯化钠固体质量增多可能是下列原因中的(填字母序号)________.
| A.溶解NaCl固体时,没有用玻璃棒搅拌 |
| B.称量5g NaCl固体后,称量纸上仍留有固体 |
| C.蒸发时,未及时停止加热,有固体溅出 |
| D.蒸发后所得NaCl固体中仍含有水分 |
(3)上述实验过程中一定属于饱和溶液的是(填数字序号,下同)________,溶质与溶剂质量比一定相等的是________.
人类的生产生活离不开金属,下列三种金属使用的先后顺序依次为:铜、铁、铝.
(1)金属被使用的先后顺序跟________(填序号)选项关系最大.
①地壳中金属元素的含量;②金属的导电性;③金属的活动性.
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质的质量分数的足量稀盐酸中(反应后Mn显+2价),请回答:
| 金属 |
铁 |
锰 |
| 与稀盐酸反应现象 |
放出气泡速率缓慢 |
放出气泡速率较快 |
| 结论 |
活动性铁________锰(填“>”或“<”) |
除了比较与酸反应产生气体速率的快慢,请你再举出一种可比较这两种金属活动性强弱的方法(写出所需药品即可):________________________________________________.
(3)将一定量的铝加入到硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加入盐酸,有气泡产生.则滤渣中一定有的物质是________________.(填化学式)
小琴同学设计了图所示的A、B两个实验.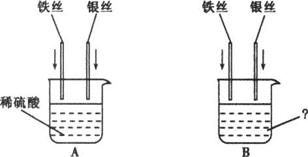
(1)实验时,她为了除去铁丝和银丝表面的氧化物或污物,其操作是________________.
(2)A实验的目的是________________________;实验时,将铁丝和银丝同时插入稀硫酸中,可观察到的现象是________________________________________________________;所发生反应的化学方程式为________________________________________.
(3)B实验中,当烧杯内盛有________溶液时,可验证Fe、________________、Ag三种金属的活动性强弱.
阅读下列科普短文:
都市中的光化学烟雾在温暖、干燥而且阳光充足的日子特别严重。它的原级污染物,主要是一氧化氮(NO)。一氧化氮乃是空气中的氮气和氧气,在汽车引擎的高温下,相互反应而生成。事实上,这个一氧化氮的生成过程,与闪电时产生一氧化氮的过程相同。其他光化学烟雾的原级污染物,包括汽油挥发所产生的碳氢化合物和一氧化碳(CO)。
一氧化氮是一种无色的气体,但是当它从汽车废气排入空气后,与空气中的氧气反应,产生红棕色的二氧化氮。二氧化氮(NO2)可以与空气中的水分子起作用,而生成硝酸(HNO3)和亚硝酸(HNO2)。这个反应同时也会帮助空气中的水汽凝聚。但是由于硝酸及亚硝酸的酸性极强,如果吸入含有这种液体微滴的空气,将对人体造成相当程度的伤害。
依据文章内容,回答下列问题:
(1)NO的物理性质。
(2)NO和NO2的化学性质不同的原因。
(3)用化学方程式表示产生NO的过程。
(4)NO2和H2O反应的化学方程式是。
(5)你认为应该如何防止光化学污染。(写一条即可)