小琴同学设计了图所示的A、B两个实验.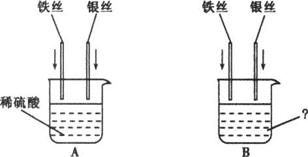
(1)实验时,她为了除去铁丝和银丝表面的氧化物或污物,其操作是________________.
(2)A实验的目的是________________________;实验时,将铁丝和银丝同时插入稀硫酸中,可观察到的现象是________________________________________________________;所发生反应的化学方程式为________________________________________.
(3)B实验中,当烧杯内盛有________溶液时,可验证Fe、________________、Ag三种金属的活动性强弱.
医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水和氯化钙(CaCl2·2H2O)的流程如下图所示。
|

|
滤液…→CaCl2·2H2O
①加盐酸② 加Ca(OH)2③操作a

 滤渣
滤渣
以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 |
H2O2溶 液浓度% |
H2O2溶液体积/mL |
温度℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| ③ |
30 |
5 |
35 |
2 |
49.21 |
|
| ④ |
30 |
5 |
55 |
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与有关;从实验
和对比可知,化学反应速率与温度的关系是:;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量(选填“减小”或“不变”或“增大”)。
下图为某些物质间的转化关系,其中A是白色固体,甲是黑色固体,B为气体单质、C和乙在常温下均为无色液体,E为最常用的金属单质之一,H是一种红褐色沉淀。(部分反应物、生成物、反应条件已略去)
(1)物质D的化学式;
(2)甲在反应①中所起的作用是;
(3)举出防止E的制品锈蚀的一种方法;
(4)写出下列反应的化学方程式
①;
⑤;
⑦。
已知:①常温常压下,A为无色液体,A在二氧化锰催化作用下分解为水和B,B是空气的组成成分之一。②C单质在足量的B中燃烧生成气体D,D能使澄清石灰水变浑浊。③C单质在不足量的B中燃烧生成有毒气体E,E与红色物质F的反应是工业炼铁的原理。请按要求填空:
(1)A的化学式。
(2)简述如何检验B。
(3)B与C生成D基本类型是反应。
(4)完成E与F反应的化学方程式。
某同学对酸碱盐的知识进行了以下的梳理。
(1)填写下表空格中的化学式:
| 氯化钾 |
氯化钙 |
氯化钠 |
氯化镁 |
氯化铝 |
氯化锌 |
氯化亚铁 |
氯化铜 |
|
|
|
|
|
|
反思:根据以上盐中的金属元素的排列,可以得出是依据顺序归纳整理的。
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了下图。请你在右边的圆圈中填入适当的化学式或离子符号:
(3)此同学通过查阅资料,发现许多反应都有盐类物质生成(如图)。比如①用稀硫酸除铁锈;②古代记载的湿法冶金技术有"曾青得铁则化为铜",其中"曾青"是指硫酸铜溶液。请从①、②中任选一个,写出反应的化学方程式:。