(13分) 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题: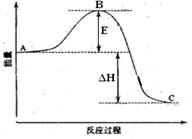
 (1)图中A、C分别表示 、
(1)图中A、C分别表示 、
(2) E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?  (3)图中△H= KJ·mol-1;
(3)图中△H= KJ·mol-1; (4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、  (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接加入净化后的甲醇。同时向一个电极通入空气。
回答如下问题:
(1)配平电池放电时发生的化学反应方程式:
□CH3OH+□O2→□CO2+□H2O
(2)在硫酸电解液中,CH3OH(C为-2)失去电子。此电池的正极发生的反应是 ,负极发生的反应是 。
(3)电解液中的H+向极移动;向外电路释放电子的电极是。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其主要有两点:首先燃料电池的能量转化效率高,其次是 。
(5)甲醇燃料电池与氢氧燃料电池相比.其主要缺点是甲醇燃料电池的输出功率较低.但其主要优点是 。
下图中每一方框中的字母代表一种反应物或生成物。已知:A、B、C、D均为前三周期元素的单质,也是中学化学教材中常见的物质。其中A、B为固体,且B是良好的半导体材料,C、D为气体,电解H的饱和溶液生成x、C和D,此反应是一个重要的化工反应(物质间相互转化时参加反应或生成的H2O已略去)
(1)B单质为 .列举B的氧化物的一种重要的工业用途为 。
(2)X的电子式为 ,Y是(填化学式) 。
(3)E和G在水溶液中混合反应,其离子反应方程式为
。
若在E的水溶液中通入过量的CO2,其离子反应方程式为
。
(4)25℃时用石墨电极电解含0.2 mol H的水溶液,在阳极产生0.2 mol气体时,测得此时溶液的体积为200 mL,则该溶液中C(OH-)最接近的数值为 。
(10分)在常温常压下,都用惰性材料作电极.分别电解(同浓度、同体积、通过相同电量)下列溶液:
| A.CuSO4 | B.AgNO3 | C.KOH | D.H2SO4 E.NaCl F.Na2SO4 |
通电一段时间切断电源,请填写下列空白。
(1)在A中一个电极上质量增加了0.128 g,在B中一个电极上质量增加,增加的物质是.
(2)在一极产生O2,同时另一极产生H2(填写序号,下同).
(3)电解后,溶液中的C(OH-)增大
(4) 电解后,溶液的pH减小.
(5)电解后,溶液的浓度增大而[H+]不变.
电解原理在化学工业上有着广泛的应用。图中电解池a为电解液,X和Y是两块电极板。则:
(1)若X和Y均为惰性电极,a为饱和的NaCI溶液,则电解时检验Y电极反应产物的方法是 。
(2)若X、Y分别为石墨和铁,A乃为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象为 。
(3)若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
为节省药品和时间.甲、乙、丙三位同学用铜片、锌片、稀硫酸、直流电源、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学将铜片和锌片插入盛有稀硫酸的烧杯中(铜与锌不接触),观察到的现象是 。
(2)乙同学接着甲同学的实验,用导线将铜片和锌片连接起来组成原电池,此时在正极上观察到的现象是 ,负极的电极反应式为 。
(3)丙同学接着乙同学的实验,去掉连接铜片和锌片的导线,将铜片和锌片分别与同一直流电源的正极和负极连接,再向烧杯中加入一定量的CuSO4溶液进行电解。此时阴极的电极反应式为 ,电解过程中溶液的pH (填“增大”、“减小”或“不变”)。
(4)甲、乙、丙3位同学能达到比较铜和锌的金属活动性相对强弱的目的的是 。
| A.只有甲同学 | B.甲和乙同学 |
| C.乙和丙同学 | D.甲、乙和丙同学 |