下列物质中碱性最弱的是
| A.氢氧化钠 | B.氢氧化镁 | C.氢氧化铝 | D.氢氧化钙 |
已知:X2、Y2、Z2、W2四种物质的氧化能力W2>Z2>X2>Y2,下列氧化还原反应能发生的是()
| A.2NaW+Z2=2NaZ+W2 | B.2NaX+Z2=2NaZ+X2 |
| C.2NaY+W2=2NaW+Y2 | D.2NaZ+X2=2NaX+Z2 |
已知反应:2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3③I2+SO2+2H2O=H2SO4+2HI,判断下列物质的还原能力由强到弱的顺序是()
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
下列叙述中正确的是()
| A.含最高价元素的化合物,一定具有强氧化性 |
| B.阳离子只有氧化性,阴离子只有还原性 |
| C.失电子越多,还原性越强 |
| D.强氧化剂与强还原剂不一定能发生氧化还原反应 |
.实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是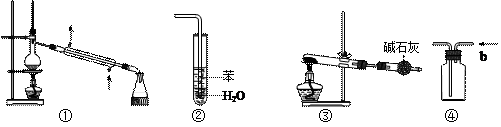
| A.装置①常用于分离互不相溶液体混合物 |
| B.装置②可用于吸收HCl气体,并防止倒吸 |
| C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D.装置④b口进气可收集CO2、NO等气体 |