(1)在室温下测得0.1mol·L-1氨水PH=11,则该温度下氨水的电离度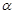 =__________
=__________
(2)25℃时在0.1mol·L-1的H2A水溶液中,用氢氧化钠来调节溶液的pH,得到其中含H2A、HA-、A2-三种微粒的溶液。
①当溶液的pH=7时,c(Na+)=__________(填微粒间量的关系)
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时溶液为__________溶液(填物质)。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和液态水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是__________。
(4)甲醇—空气燃料电池是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH+3O2=2CO2+4H2O。其工作原理示意图如下(其中a、b、c、d四个出入口表示通入或排出的物质)。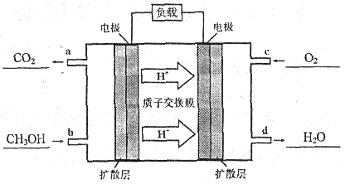
则负极的电极反应式为__________;正极的电极反应式为__________
碘是人体中不可缺少的微量元素。食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%
(1)食盐中加入碘化钾的碘损失率高的原因是 ;
(2)萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A、酒精B、四氯化碳 C、乙酸
(3)可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:5KI+KIO3 + 6HCl ="=" 6KCl + 3I2 + 3H2O,反应的现象是 ;
(4)已知碘酸钾受热易分解,你认为在用碘酸钾加碘盐进行烹饪时应注意什么问题? 。
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:_________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表所示:
| n(SO32-)∶n(HSO3-) |
91∶9 |
1∶1 |
9∶91 |
| pH |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释__________________。
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)________。
a. c(Na+)=2c(SO32-)+c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c. c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
① HSO3-在阳极放电的电极反应式是 。
② 当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理_______________。
【化学——选修化学与技术】明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题: (1)在焙烧明矾的反应中,还原剂是 ;
(1)在焙烧明矾的反应中,还原剂是 ;
(2)从水浸后的滤液中得到K2SO4晶体的方法是 ;
(3)A12O3在一定条件下可制得AIN,其晶体结构如图所示,该晶体中Al的配位数是 ;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 ;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g)△H1= 一197 kJ/mol;
2SO3(g)△H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是 ;
(6)焙烧948吨明矾(M=474g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸 吨。
Ⅰ、醉驾对人们的安全危害很大,利用下列原理可以检查司机是否酒后开车。
2K2Cr2O7(橙色)+3C2H5OH+H2SO4 →Cr2(SO4)3(绿色)+K2SO4+CH3COOH+H2O
①配平化学方程式后,H2O前面的系数为;
②怎样判断司机是酒后开车:。
③写出用粮食酿酒的化学方程式:;。
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子。据此回答下列问题:
(1)A的组成是(填化学式)。
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是。
(3)A中某组分可由单质与水反应制得,化学方程式为:。
(4)电解所用装置如图所示。
①电解开始阶段,阳极上的电极反应是,阴极上的电极反应是。
②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是。
A—F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 |
结构或性质 |
| A |
原子最外层电子数是内层电子总数的1/5 |
| B |
形成化合物种类最多的元素,其单质为固体 |
| C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是;A与E形成的化合物的电子式是。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是。
(4)F的盐酸盐水溶液呈酸性,原因是(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是。
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和上图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。a是;b是。
②合金中A元素的质量分数是(用含m、a、b的式子表示)。