短周期元素A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)写出D元素的基态原子电子排布式 。C、D、E的简单离子半径由小到大的顺序 (用离子符号表示)。
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式 。
检验该气体的常用方法是 。
(3)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(4)A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是 。
(5)电动汽车的某种燃料电池,通常用NaOH作电解质,用E单质、石墨作电极,在石墨电极一侧通入空气,该电池的正极反应: 。
(1)用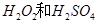 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: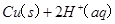 ====
====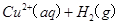 △H=64kJ/mol ①
△H=64kJ/mol ①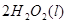 ====
====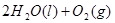 △H= -196kJ/mol ②
△H= -196kJ/mol ②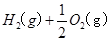 ="==="
="===" 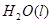 △H= -286kJ/mol ③
△H= -286kJ/mol ③
在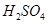 溶液中
溶液中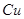 与
与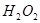 反应生成
反应生成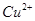 和
和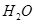 的热化学方程式
的热化学方程式
为。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅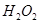 和3.0 mol/L的
和3.0 mol/L的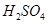 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温 度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
| 铜平均溶解速率 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
|
( ) ) |
||||||||
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因
是。
(3)在提纯后的 溶液中加入一定量的
溶液中加入一定量的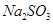 和
和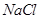 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是。
的离子方程式是。
(6分)某课外活动小组同学用下图装置进行实验,试回答下列问题。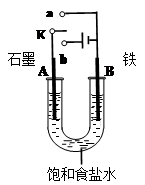
(1)若开始时开关K与b连接,则B极的电极反应式为。
总反应的离子方程式为。
有关上述实验,下列说法正确的是(填序号)。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为。
用离子方程式表示下列反应
(1)Cl2通入NaHCO3水溶液中
(2)向Fe(NO3)2滴入几滴稀硫酸
(3)SO2通入高锰酸钾酸性溶液中
(4)向FeBr2通入等物质的量的Cl2
(5)向明矾溶液中滴入Ba(OH)2溶液,使得产生的沉淀质量最大
(10分)把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________。
(5)在500mL 0.1 mol·L-1的FeCl2溶液中通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液加入足量的AgNO3溶液,得到2.009g沉淀。原溶液中被氧化的Fe2+的物质的量为__________mol;若将剩余的Fe2+全部氧化,还需加入0.5 mol·L-1的稀硝酸_________ mL。
已知X、Y、Z三种元素都属于1~18号元素,它们的核电荷数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的3倍,Y和Z形成的单质都是自然界循环的两种气体,且Y和Z可以形成两种以上的气态化合物,则;
(1)X、Y、Z的元素名称分别为_______ , ________ , ________
(2)有Y和Z组成,且Y和Z的质量比为7:16的化合物的化学式为________ 或_________
(3)有X、Y、Z中的两种元素组成,且与X2Z分子具有的电子数的两种离子是______和_____
(4)X、Y、Z三种元素可以形成一种盐,此盐中X、Y、Z元素原子的个数比为4︰2︰3,该的化学式是_______