主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:
⑴A、B、C、D分别是 、 、 、 ;(填元素符号)
⑵D的离子结构示意图为 ,A与B形成的化合物的电子式为 ;
⑶B、C的气态氢化物稳定性由强到弱的顺序为: (写化学式,并用“<”或“>”表示强弱)。
(4)写出一种由A、B、C、D组成的化合物的化学式 。
H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):
①
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2:。
(2)A→B反应过程中涉及的反应类型有。
(3)写出D分子中含有的官能团名称:。
(4)写出生成F与足量氢氧化钠溶液在加热条件下反应的化学方程式。
(5)写出E在铜催化下与O2反应的化学方程式:。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有种(不包括立体异构),其中核磁共振氢谱为5组峰的为(写结构简式)。
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g)△H1= +131kJ/mol
C(s)+O2(g)=CO2(g)△H2= —394kJ/mol
CO(g)+1/2O2(g)=CO2(g)△H3= —283kJ/mol
则CO(g)+H2O(g) H2(g)+CO2(g)△H=
H2(g)+CO2(g)△H=
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) H2(g)+CO2(g),得到如下三组数据:
H2(g)+CO2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
反应达平衡时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
5 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验l中以 CO2表示的反应速率为。
②在900℃时,此反应的平衡常数K=
③若其它条件不变向实验2的平衡混合物中再加入0.4 mol H2O和0.4 mol CO2,达到新平衡时CO的转化率将(变大、变小、不变)
(3)将标准状况下224mLCO2通入200mL 0.1 mol/L KOH溶液中,充分反应后得到溶液X,若不考虑溶液体积的变化,下列有关X的叙述不正确的是
A、c(OH-)=c(H+)+ c(HCO3—)+ 2c(H2CO3)
B、该溶液中,c(K+) > c(CO32—) > c(OH-) > c(HCO3—)> c(H+)
C、该溶液中,水电离出的c(OH-)大于水电离出的c(H+)
(4)以CO和O2为原料,用KOH作电解质组成燃料电池,则该电池负极的反应式为。
若将该电池作电源,以石墨为电极电解硫酸铜溶液,当产生时0.64gCu,理论上至少需要消耗标况下的CO气体mL
(13分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下: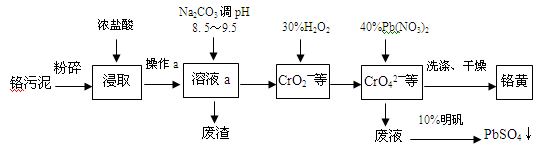
(1)操作a的名称为。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式。
(3)写出加入30%H2O2过程中发生的离子反应方程式:。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72
 -发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因。
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为mol。
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如下图:
(1)如果把电键K接A,这一装置形成电解池装置,____是阳极,其电极反应式是_________________;
(2)上述反应进行5min后,转换电键K到C,这一装置形成原电池装置,________极是负极,该装置发生反应的总化学方程式是______________
(3)上述装置进行2min后,再转换电键K到B,在极上发生的腐蚀属于电化学腐蚀。
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于5 (已知Ksp[Cu(OH)2]=2.0×10-20)。