某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2 + 2NaOH="==" NaNO3 + NaNO2 + H2O
任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
(1)E装置中制取NO2反应的化学方程式是 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③ 。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如右图所示),重新组装,进行实验。
①装置的合理连接顺序是(某些装置可以重复使用) 。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为
(2)两同学利用下图所示装置进行测定
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为、洗涤、干燥。
②装置E中碱石灰的作用是。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号)。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为。
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: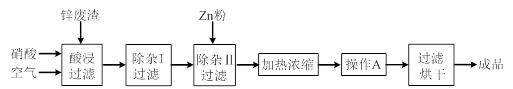
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的。
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为。
(4)可用如图实验装置精制粗溴。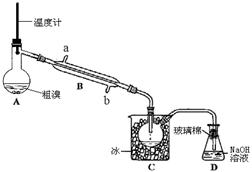
①图中冷却水应从B的口进入(填“a”或“b”) 。
②C中加冰的目的是降温,减少溴的。
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。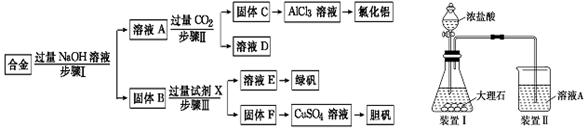
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有。
(2)溶液A中的离子主要有Na+、OH-、;试剂X是。
(3)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,
观察到烧杯中产生的白色沉淀逐渐减少,其原因是(用离子方程式表示);为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和溶液的洗气瓶。
(4)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
部分物质的有关物理数据如下:
| 化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
| N2 |
-209.86 |
-195.8 |
| O2 |
-218.4 |
-183 |
| CO2 |
-57 |
/ |
| NH3 |
-77.3 |
-33.35 |
| Cl2 |
-101 |
-34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式:。
(2)B中盛有液体c是饱和,C中的液体d是浓硫酸。
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而。