工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: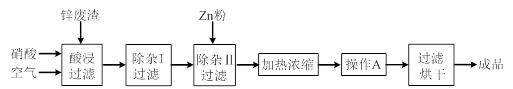
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为 ,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~ 。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加 溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的 。
某课外活动小组利用如图所示装置分别做如下实验: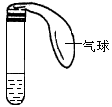
①在试管中注入某红色溶液,加热试管,溶液颜色变浅,冷却后
恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:_________________________。②在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是_____________溶液;加热时溶液由无色变为红色的原因是:__________________________________。
在学习“塑料、橡胶和纤维”时,我们对几种纤维的性质进行了科学探究。
①取一小块纯棉布、羊毛织物(或蚕丝织物)和尼龙布,分别在酒精灯火焰上灼烧,观察现象。②另取上述材料各一小块,分别浸入10%H2SO4溶液和3%NaOH溶液中,微热5~6min,取出用水漂洗、烘干。③把通过②处理过的织物与没有用酸、碱处理的织物进行对比。
回答下列问题:⑴完成实验现象记录表。
| 灼烧情况 |
受10%H2SO4溶液影响情况 |
受3%NaOH溶液影响请况 |
|
| 纯棉布 |
易燃烧,有烧纸的气味,灰烬一触即碎 |
轻微 |
轻微 |
| 羊毛(或蚕丝织物) |
接近火焰卷缩,有味,灰烬为黑色、膨胀易碎的颗粒 |
||
| 尼龙布 |
接近火焰卷缩,有特殊气味,趁热可拉成丝,灰烬为灰褐色玻璃球状 |
几乎不变 |
几乎不变 |
⑵通过本次探究,你认为合成纤维(如尼龙)与天然纤维相比较,其突出性能是;
⑶对于纯棉布、羊毛(或蚕丝)和尼龙布衣物,你认为可以在较高温度下熨烫的是;
⑷加酶洗衣粉中的碱性蛋白酶制剂可以使奶渍、血渍等多种蛋白质污垢降解成易溶于水的小分子肽。在洗涤纯棉布、羊毛(或蚕丝)和尼龙布衣物时,你认为不能使用加酶洗衣粉的是。
将Zn投入一定浓度一定体积的盐酸中,H2的生成速率与时间的关系如图所示,试解释图中曲线变化的原因(纵坐标为H2的生成速率,横坐标为时间)。
答:①;
②。
有A、B、C三块金属浸泡在稀硫酸中,用导线两两相连要以组成各种原电池。若A、B相连,A为负极;B、C相连,B上有气泡逸出;A、C相连,A极减轻。则三种金属的活动性顺序由大到小排列为。
向一个小烧杯中加入20克蔗糖,加3~4滴水,再加入20ml浓硫酸,观察到的实验现象是:烧杯发热、蔗糖变黑、体积膨胀,变成疏松多孔的海棉状的炭,并放出有制激性气味的气体。这个过程表现出浓硫酸的特性是。