某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。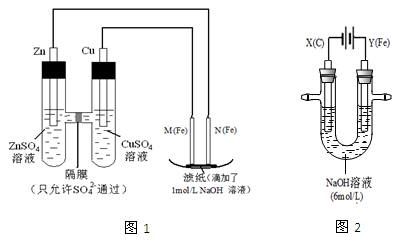
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
| A.铝 | B.石墨 | C.银 | D.铂 |
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- ="=" FeO42- + 4H2O 和
。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为: K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2该电池正极发生的反应的电极反应式为 。
某有机物甲和A互为同分异构体,经测定它们的相对分子质量小于100;将1mol甲在O2中充分燃烧得到等物质的量的CO2和H2O (g) ,同时消耗112LO2(标准状况);在酸性条件下将1 mol甲完全水解可以生成1 mol 乙和1mol丙;而且在一定条件下,丙可以被连续氧化成为乙。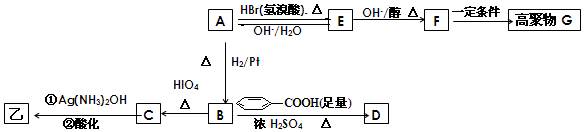
经红外光谱测定,在甲和A的结构中都存在C=O双键和C-O单键,B在HIO4存在并加热时只生成一种 产物C,下列为各相关反应的信息和转化关系:
产物C,下列为各相关反应的信息和转化关系: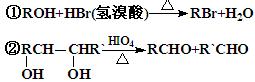
⑴ 请确定并写出甲的分子式 ▲;与甲属同类物质的同分异构体共有 ▲种(包含甲)。
⑵ E → F 的反应类型为 ▲反应;
⑶ A的结构简式为 ▲;G 的结构简式为 ▲;
⑷ B →D的反应化学方程式为 ▲;
⑸ 写出C在条件①下进行反应的化学方程式 ▲。
已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。请回答以下问题:
(1)A分子的空间构型为 ;Y在周期表中的位置 ;
(2)写出气体D通入水中的化学反应方程式________________________;
(3)E具有不稳定性,因此实验室中保存E的方法是 ;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式: ,当反应中转移的电子为3mol时,被氧化的A在标准状况下的体积为 L。
元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。
(1)阴影部分元素N的最高价氧化物为 。根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:H3AsO4H3PO4。(用 “>”、“<”或“=”表示)
“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为、,
(3)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”)。
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式
(5)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为
______________________________________ ;
氢气燃烧生成液态水的热化学方程式是:
2H2(g)+O2(g) ===2H2O(l)ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于 ”)反应物能量总和。
”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量(填“>”、“<”或“=”)572 kJ。
(4分)下列六种物质的变化中,将合适序号填写在下列空白中:
①干冰的升华; ②硫酸钾熔化; ③NaCl溶于水; ④HCl溶于水; ⑤液氨的受热蒸发; ⑥Na2O2溶于水
(1)仅需要克服分子间作用力的是 。(2)发生离子键破坏,又发生共价键破坏的是。(3)发生共价键破坏的是。(4)发生离子键破坏的是。
。(2)发生离子键破坏,又发生共价键破坏的是。(3)发生共价键破坏的是。(4)发生离子键破坏的是。