(16分)化合物IV为一种重要化工中间体,其合成方法如下: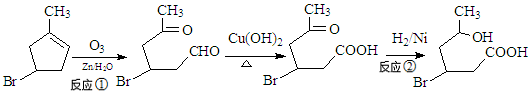
(1)化合物II的化学式为
(2)反应②的反应类型为 ,1mol化合物III与足量NaOH反应消耗NaOH的物质的量为 。
(3)化合物I在NaOH的醇溶液中反应得到化合物X,写出化合物X可能的结构简式
(4)化合物IV在浓硫酸条件下反应生成的六元环化合物V,写出该反应的化学方程式
(5) 异黄樟油素( )发生类似反应①的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
)发生类似反应①的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________。
目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置: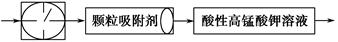
①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂: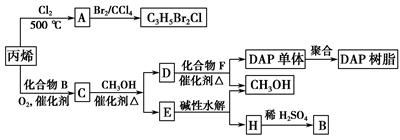
已知酯与醇可发生如下酯交换反应:
RCOOR′+R″OH催化剂△RCOOR″+R′OH(R、R′,R″代表烃基)
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
①A的结构简式是____________________________________________________,
A含有的官能团名称是________;
②由丙烯生成A的反应类型是________。
(2)A水解可得到D,该水解反应的化学方程式是_____________________________________。
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是________。
(4)下列说法正确的是(选填序号字母)________。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环用于DAP树脂的制备。其中将甲醇与H分离的操作方法是________。
(6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是_______________________________________________________________。
我国是个农业大国,农业是立国之本,“农村、农业、农民”是党中央新时期农村工作的重心,化肥与农药的发展起着巨大的推动作用,请回答下列问题:
(1)农作物生长过程中不可缺少的微量元素有Fe、Mn、B、Cu、Mo等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质的形成和新陈代谢不可缺少的。常用铜肥是胆矾,在盐碱地(土壤pH>7)施用胆矾时宜将溶液________(填“喷在叶片上”或“随水灌入土壤中”),主要理由是____________________________________________________。
(2)农药波尔多液是一种常用的杀菌剂,常用配方为胆矾、生石灰、水,按质量比1∶0.56∶100混合,分析其防治病虫害的原因____________________________________。
(3)拟除虫菊酯是一种高效、低毒,对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图。
其分子式为________,则下列对该化合物的叙述正确的是________。
A.该化合物属于芳香烃
B.该化合物属于卤代烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
请你参与识别化肥的探究活动,有五种化肥,分别是硫酸钾、氯化钾、碳酸氢铵、氯化铵和硝酸铵。
第一步:称取五种化肥各10 g,分别研细;
第二步:硝酸铵和熟石灰反应的化学方程式是:_____________________________________。
第三步:另取三种铵盐各少量,分盛于三支试管中,均滴入少量盐酸,无明显现象的是____________,有气泡放出的是________。反应的化学方程式:______________________________________________________________。
第四步:另取氯化铵和硝酸铵两种铵盐进行识别,写出识别时发生反应的化学方程式:_____________________________________________________________。
第五步:取两种钾盐,分别在试管中配成溶液,各滴入几滴氯化钡溶液,生成白色沉淀的钾盐是________,无明显现象的钾盐是________。