A为芳香烃衍生物,只含C、H、O三种元素,苯环上有两个处于邻位的取代基。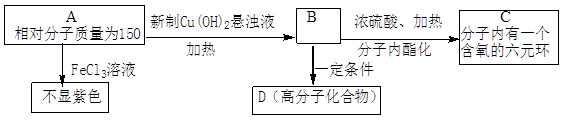
(1)B分子中含氧官能团的名称是 。
(2)写出符合上述条件的A的两种可能的结构简式: ; 。
(3)等量的B分别与Na,NaOH,Na2CO3反应时,消耗三者物质的量之比是 。
(4)符合上述条件的A,其中一种还可发生如下变化:
①A→ F的反应类型为 。
②写出有关反应的化学方程式:
此A与新制Cu(OH)2悬浊液的反应: ;
此A对应的B生成C的反应: 。
A、F、G是单质,其中A、F是金属单质,且A是现在用途最广用量最大的金属。F具有黄色的焰色反应,G是黄绿色气体;B、C、D、E是化合物;E到D的现象为白色沉淀变为灰绿色,最后变为红褐色,它们之间存在如下图所示的转化关系(生成物没有全部写出):
(1)推断:A__________F_______(填化学式)
(2)写出E→D的化学方程式____________。
(3)写出C→B的离子方程式________________________。
硅和硅的化合物既是传统的无机非金属材料又是重要的现在新型材料。
(1)陶瓷、玻璃、水泥的组成中的共同成分是__________盐。
(2)2009年,华裔科学家高锟以研究传播力纤维光信号传输的骄傲成绩获得诺贝尔物理奖,制造光导纤维的原材料是______________。
新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空。
①使新制绿水呈现浅黄绿色的物质是___________________.
②能起杀菌消毒作用,光照易分解的弱酸是______________.
③能与硝酸银作用生成白色沉淀的离子是_______________.
(10分)下表列出了①~⑥六种元素在元素周期表中的位置。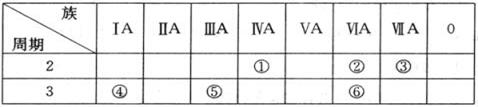
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是____(填写元素符号);
(2)元素①③⑥的氢化物的化学式分别是__ __;___ _;__ _ _.
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是______ ____________。
(6分)下列三种有机物中:
A.淀粉B.CH2=CH2C.CH3COOH
(1)水溶液显酸性且是食醋的主要成分是(填编号,下同)。
(2)可用于合成聚乙烯塑料的是。
(3)通常用于检验碘单质的是。